[그림 1]

| 사건번호 | 2014허4913 등록무효(특) |
|---|---|
| 판례제목 | 2014허4913 등록무효(특) |
| 출원번호 | 제0885129호 |
| 분야 | 특허/실용신안 |
| 판결일 | 2016-01-21 |
| 법원명 | 특허법원 |
| 원고 | 노파르티스 아게 |
| 피고 | 씨제이헬스케어 주식회사, 보령제약 주식회사, 주식회사 종근당, 제일약품 주식회사, 제이더블유중외제약 주식회사, 동아에스티 주식회사, 일동제약 주식회사 |
| 판사 | 김환수, 곽부규, 김부한 |
| 판결결과 | 등록무효 |
| 주문 | 1. 특허심판원이 2014. 6. 10. 2013당257, 2013당688(병합), 2013당708(병합), 2013당1309(병합), 2013당1467(병합), 2013당1468(병합), 2013당1855(병합) 사건에 관하여 한 심결을 취소한다. 2. 소송비용은 피고들이 부담한다. |
| 청구취지 | 주문과 같다. |
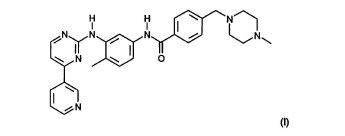
| 기초사실 | 가. 이 사건 심결의 경위 1) 피고 씨제이헬스케어 주식회사의 분할전 회사 씨제이제일제당 주식회사는 2013. 2. 1. 2013. 2. 1. 2013당257호로, 피고 보령제약 주식회사는 2013. 3. 22. 2013당688호로, 피고 주식회사 종근당은 2013. 3. 25. 2013당708호로, 피고 제일약품 주식회사는 2013. 5. 16. 2013당1309호로, 피고 제이더블유중외제약 주식회사는 2013. 6. 3. 2013당1467호로, 피고 동아에스티 주식회사는 2013. 6. 3. 2013당1468호로, 피고 일동제약 주식회사는 2013. 7. 11. 2013당1855호로 각 특허심판원에 특허권자인 원고, 다나-파버 캔서 인스티튜트 인크., 오레곤 헬스 싸이언시즈 유니버시티, 브리검앤드위민즈하스피탈 인코포레이티드를 상대로, 이 사건 특허발명의 청구항 2, 4, 5, 6(이하 이 사건 특허발명의 청구항 2를 ‘이 사건 제2항 발명’이라 부르고, 나머지 청구항도 같은 방식으로 부른다)이 선행발명 1, 2에 의하여 신규성이 부정되거나, 그 발명이 속하는 기술분야에서 통상의 지식을 가진 사람(이하 ‘통상의 기술자’라 한다)이 선행발명들에 의하여 쉽게 발명할 수 있으므로 진보성이 부정된다고 주장하면서 등록무효심판을 청구하였다. 2) 위 씨제이제일제당 주식회사는 2014. 4. 1. 회사 일부를 분할하여 피고 씨제이헬스케어 주식회사를 설립하였다. 3) 특허심판원은 피고들의 위 심판청구들을 병합 심리하고 2014. 6. 10. 이 사건 제2, 4, 5, 6항 발명이 선행발명 1 내지 3에 의해 진보성이 부정된다는 이유로 피고들의 위 청구를 인용하는 이 사건 심결을 하였다. 나. 이 사건 특허발명(갑 제2호증) 1) 명칭: 위장관의 기질 종양의 치료 2) 국제출원일/ 우선일/ 등록일/ 등록번호: 2001. 10. 26./ 2000. 10. 27./ 2009. 2. 17./ 제0885129호 3) 특허권자: 원고, 다나-파버 캔서 인스티튜트 인크., 오레곤 헬스 싸이언시즈 유니버시티, 브리검 앤드 위민즈 하스피탈 인코포레이티드 4) 발명의 주요 내용 가) 기술분야 본 발명은 4-(4-메틸피페라진-1-일메틸)-N-[4-메틸-3-(4-피리딘-3-일)피리미딘-2-일아미노)페닐]-벤즈아미드(이하 ‘화합물 I’이라 한다) 또는 그의 약제학적으로 허용되는 염의 위장관의 기질 종양(Gastrointestinal Stromal Tumor: GIST)의 치료에 사용하기 위한 약제학적 조성물을 제조하기 위한 용도, 화합물 I 또는 그의 약제학적으로 허용되는 염의 GIST의 치료용 용도 및 화합물 I 또는 그의 약제학적으로 허용되는 염의 유효 용량을 치료가 필요한 동물에게 투여함으로서 GIST로 고생하는 인간을 포함하는 온혈동물의 치료방법에 관한 것이다(문단번호 <1>). 나) 배경기술 위장관의 기질 종양(GIST)은 위장관, 대부분의 경우 위장(모든 GIST의 60 ∼ 70%)에서 기원하는, 중간엽 종양으로 최근에 특징화된 종류이다. 과거에는 상기 종양을 평활근종, 평활근모세포종 또는 평활근육종으로 대별하였다. 그러나 이제 GIST가 그의 독특한 분자 병인론 및 임상적 특징에 기초하여 독특한 임상병리적 현상을 나타냄이 명백해졌다. GIST는 일반적으로 중년 또는 50 내지 60살 중반의 장년에서 발생하고, 빈도에 있어서 성적인 차이를 나타내지 않는다. 적어도 10 ~ 30%의 GIST가 악성이고, 일반적으로 간 및 복막시딩(seeding)에서 발견되는 내부-복부의 전개 및 전이를 일으킨다고 평가된다. 악성 GIST는 100,000당 약 0.3의 새로운 케이스의 빈도로 연간 발생한다. 매우 일반적으로 나타나는 증상은 막연한 상부 복부의 통증이다. 많은 경우(30%) 자각증상이 없고, GIST는 종양에 관련된 위장관 출혈의 결과로 발생되는 빈형의 측정동안에 진단될 수 있다(문단번호 <2>). GIST가 암 화학치료법에 반응하지 않는다고 알려졌기 때문에, 전이성 및 수술 불가능한 GIST의 처치가 가장 큰 문제이다. 예컨대, 최근 상(phase)Ⅱ 시리즈에서, 진행성 평활근육종을 갖는 18명 중 12명(67%)의 환자가 다카바진, 미토마이신, 독소루비신, 시사플라틴 및 사르그라모스팀으로 구성된 요법에 반응한 반면, 21명의 GIST 중 오직 1명(5%)이 반응하였다. 치료 결과 다른 화학요법에서도 유사한 결과는 나타내었다(문단번호 <3>의 1 ~ 7행). 다) 발명을 실시하기 위한 구체적인 내용 화합물 I 또는 그의 약제학적으로 허용되는 염으로 GIST를 성공적으로 치료할 수 있다는 것이 본 발명에서 놀랍게도 증명되었다(문단번호 <4>). 화합물 I은 하기 화학식 (I)을 갖는 4-(4-메틸피페라진-1-일메틸)-N-[4-메틸-3-(4-피리딘-3-일)피리미딘-2일아미노)페닐]-벤즈아미드이다(문단번호 <5>). 화합물 I의 제조 및 그의 사용, 특히 항암제로서의 사용은 1993. 10. 6.에 공개된 유럽 특허출원 EP-A-0 564 409의 실시례 21에 기술되어 있고, 이에 동등한 출원 및 특허, 예컨대, 미국 특허 5,521,184호 및 일본 특허 2706682호 등 다수의 다른 나라에서 개시되었다(문단번호 <7>). 화합물 I의 모노메탄설폰산 부가염(이하 ‘염 I’이라 한다) 및 이의 바람직한 결정 형태는 1999. 1. 28.에 공개된 PCT 특허 출원 W099/03854호에 개시되어 있다(문단번호 <9>). 중요한 점은 경구적 염 I 치료의 임상적 독성의 프로필은 매우 양호하며, 주로 가벼운 혈구감소증 및 약한 내장의 움직임의 빈도의 증가로 나타난다(문단번호 <14>). 종(species), 연령, 객체의 조건, 투여 경로 및 당해 임상적 증상에 의존하여, 유효 용량, 예컨대, 하루 용량으로 약 100 ~ 1000mg, 바람직하게는 200 ~ 600mg, 특히 400mg을 약 70kg 체중의 온혈동물에 투여한다. 조직을 절제할 수 없고/또는 전이성 악성 GIST룰 갖는 성인 환자에 대해서, 하루 400mg의 초기 용량이 권장될 수 있다. 하루 400mg의 치료에 반응을 평가한 후에, 미온적 반응을 갖는 환자에 대해서는, 용량의 증가를 안전하게 고려할 수 있고, 환자는 치료가 안전하고, 제한되는 독성이 없는 한 치료될 수 있다 (문단번호 <15>). 본 발명은 또한 화합물 I 또는 그의 약제학적으로 허용되는 염의 약제학적 유효량을 3개월을 초과하는 기간 동안 인간 환자에게 하루 한 번 투여하는 것을 포함하는, 화합물 I 또는 그의 약제학적으로 허용되는 염을 GIST을 갖는 인간 환자에 투여하는 방법에 관한 것이다(문단번호 <16>). 5) 청구범위 【청구항 1, 3, 7, 8】 삭제 【청구항 2】 하기 화학식 (I)의 4-(4-메틸피페라진-1-일메틸)-N-[4-메틸-3-(4-피리딘-3-일)피리미딘-2-일-아미노)페닐]-벤즈아미드 또는 그의 약제학적으로 허용되는 염을 포함하는 위장관의 기질 종양 치료용 약제학적 조성물: 【청구항 4】제2항에 있어서, 화학식 (I)의 4-(4-메틸피페라진-1-일메틸)-N-[4-메틸-3-(4-피리딘-3-일)피리미딘-2-일-아미노)페닐]-벤즈아미드가 약제학적으로 허용되는 산 부가염의 형태인 것을 특징으로 하는 약제학적 조성물. 【청구항 5】제2항에 있어서, 약제학적으로 허용되는 염이 화학식 (I)의 4-(4-메틸피페라진-1-일메틸)-N-[4-메틸-3-(4-피리딘-3-일)피리미딘-2-일아미노)페닐]-벤즈아미드의 메탄설폰산염인 것을 특징으로 하는 약제학적 조성물. 【청구항 6】제2항에 있어서, 화학식 (I)의 4-(4-메틸피페라진-1-일메틸)-N-[4-메틸-3-(4-피리딘-3-일)피리미딘-2-일아미노)페닐]-벤즈아미드의 모노메탄설폰산염의 하루 용량이 200 내지 600 mg인 것을 특징으로 하는 약제학적 조성물. 다. 선행발명들 1) 선행발명 1(갑 제10호증, 싱어 논문) 2000. 10. 17. 이전에 국내에서 공지된 사무엘 싱어(Samuel Singer) 등이 작성한 ‘The Lancet Oncology, Vol. 1, 75 ~ 85면’에 게재된 “연조직 육종의 관리: 개요 및 업데이트(Management of soft-tissue sarcomas: anoverview and update)”라는 제목의 논문으로, 그 주요 내용은 다음과 같다. 세포독성 화학요법으로 연조직 육종(STS)을 통상적으로 관리하는 것이 한계가 있기 때문에 환자들, 이의 가족들뿐만 아니라 의사들도 새로운 접근법에 대해 환영한다. 다행히도, 이러한 군의 종양들의 생물학적 작용 및 병태생리를 새로이 이해하게 하는 연구들이 진행되고 있으며, 이는 새로운 치료적 전략들에 적용될 수 있다. 보다 전망 있는(promising) 예 중 하나는 지방육종의 치료이다. 지방 육종에서 PPARy(peroxisome proliferator-activated receptorgamma)로 알려진 핵 수용체는 지방세포 분화에 중요한 조절자로 인식되어 왔다. 지방육종은 지방세포 계통 세포의 비정상적 증식이 관련된, 차단된 분화의 문제로 볼 수 있기 때문에 지방세포의 말단 분화의 자극이 임상적으로 유리한 결과를 가져올 것이라고 생각하는 것은 합리적이다. 티아졸리딘디온 약물(예:트로글리타존 및 로지글리타존)은 PPARy에 결합하고 이를 활성화시키며, 원래는 당뇨병의 인슐린 민감요법제로 개발되었다. 그러나 상기 약물들은 특정의 조직학적 서브타입의 지방육종에서 세포 분화를 유도하고 세포 증식율을 감소시키는 능력으로 인해 다나-파버 캔서 인스티튜트(Dana-Farber Cancer Institute) 및 브리검 앤드 위민즈 하스피탈(Brigham and Women's Hospital)에서 실시한 임상 시험에서 특히 유망한 것으로 입증되었다. 이에 기초하여, 미국 외과의 종양 그룹 대학(American College of Surgeons Oncology Group)의 후원 하에, 지방육종이 절제된 환자에 대한 보조요법으로서의 PPARy 리간드인 로지글리타존의 임상 가치를 테스트하기 위해, 미국의 국내에서 유망한 무작위 임상 시험이 제안되어 왔다(83면 왼쪽 칼럼 2번째 단락 ~ 오른쪽 칼럼 1번째 단락). 다른 새로운 접근법들은 화학요법 저항성인 것으로 악명 높은 위장관 기질 종양에서 항상적으로 활성화된(constitutively active) c-kit 수용체 티로신키나제와 같은 합리적인 타깃을 포함한다. 본 글을 쓸 때, GIST에 대해 선택적 티로신 키나제 억제제인 STI571의 시험이 다나-파버 암 연구소에서 (다른 세계적인 연구 센터와 협력 하에) 막 시작되었고 ‘매우 초기 결과는 흥미로워 보인다(very early results look exciting)’. 마지막으로, 중요한 항육종 활성에 대한 천연 제품을 스크리닝하는 과정이 지속되고 있으며, 한 결과로 해양유기체로부터 유도된 엑테인아스시딘(ecteinascidin) 743 (ET-743)으로 알려진 새로운 화학치료제가 동정되었다. ET-743은 유럽과 미국 모두에서 조기 임상 시험에서 유망한 결과를 나타내었고, 현재는 육종 환자들에 대해 이의 가치를 증명하도록 고안된 대규모 임상시험이 진행 중이다. 종양-유도된 혈관형성의 억제나 면역 시스템에 의한 육종-선택적 항원의 잠재적 인식과 같은 다른 전략들도 임상시험을 위해 활발히 연구 중이다(83면 오른쪽 칼럼 2번째 단락 ~ 84면 왼쪽 칼럼 3행). 2) 선행발명 2(갑 제9호증, 하인리히 논문) 2000. 8. 발행되고 마이클 씨 하인리히(Michael C. Heinrich) 등이 작성한 ‘Blood, Vol. 96, No. 3, 925 ~ 932면’에 게재된 “선택적 티로신 키나제억제제, STI571에 의한 c-kit 수용체 티로신 키나아제 활성의 억제(Inhibition of c-kit receptor tyrosine kinase activity by STI571, a selective tyrosine kinase inhibitor)”라는 제목의 논문으로, 그 주요 내용은 다음과 같다. STI571(CGP 57148B)은 c-abl, bcr-abl과 혈소판 유래 성장인자 수용체(PDGFR, platelet-derived growth-factor receptor) 티로신 키나제의 공지된 억제제이다. 이 화합물은 만성 골수성 백혈병의 치료를 위한 임상 시험에서 평가가 진행 중이다. 우리는 PDGFR과 구조적으로 유사한 수용체인 c-kit의 티로신 키나제 활성의 억제력 시험을 통해 STI571의 활성 프로파일을 연장하려 했다. 우리는 Steel factor(SLF)로 자극하기 전에 c-kit를 발현하는 인간의 골수성 백혈병 세포주(M-07e)를 STI571로 처리했다. STI571은 c-kit, MAP 키나제 또는 Akt의 총단백량 농도를 변화시키지 않고, c-kit의 자가 인산화, 미토겐-활성화 단백질 (MAP) 키나제의 활성화를 억제하고, Akt의 활성화를 억제한다. 이러한 효과 즉, 50%의 억제율을 발생시키는 농도는 약 100nmol/L이었다. STI571은 또한 용량-의존적 방식으로 M-07e 세포의 SLF-의존적 성장을 유의하게 감소시켰으며 SLF의 항세포자멸사의 활성을 차단하였다. 대조적으로 이 화합물은 과립 대식세포 집락-자극인자에 대응하는 MAP 키나제 활성화 또는 세포 증식에는 영향을 미치지 않았다. 우리는 또한 인간의 비만세포 백혈병 세포주(HMC-1)에서 STI571의 활성을 시험했으며, 이 세포주는 c-kit의 활성화된 돌연변이형을 갖추고 있다. STI571은 야생형 수용체의 리간드 의존적 활성화에 대한 것보다 이러한 돌연변이형 수용체의 키나제 활성화에 대하여 강한 억제효과를 가졌다. 이러한 소견은 STI571이 세포증식 및 생존에 관여하는 목표 단백질의 c-kit 티로신 키나제 활성 및 후속의 활성화를 선택적으로 억제한다는 것을 보여준다. 이 화합물은 c-kit 키나제 활성의 증가와 연관된 암을 치료함에 있어서 유용할 수도 있을 것이다(925면 참조). c-kit는 145-kd 막통과 당단백질로 바이러스 암유전자 v-kit의 정상세포 동족체이며 혈소판 유래 성장인자(PDGF, platelet-derived growth-factor), 대식세포 집락자극인자 및 flt3 리간드에 대한 수용체를 포함하는 수용체 티로신키나제 서브클래스 III 군의 구성원이다. c-kit 유전자 생성물은 조혈간세포, 비만세포, 생식세포, 카할(Cajal) 간질세포(ICC)와 몇몇의 인간종양에 의해서 발현된다(925면 왼쪽 칼럼 1 ~ 7행). 정상세포 생리활성에서 c-kit의 중요성에 더하여 c-kit는 생식세포종양, 비만세포종양, 위장관기질종양(GIST), 소세포 폐암, 흑색종, 유방암, 급성 골수성 백혈병(AML, acute myeloid leukemia)과 신경아세포종을 포함한 특정 인간 암의 생물학적 면에서 역할을 담당한다. c-kit에 의해 매개되어지는 종양세포 성장의 증식은 리간드-비의존적 활성화를 초래하는 c-kit 폴리펩타이드의 특정 돌연변이나 수용체의 자가분비 자극에 의해 발생한다. 특정 종류의 종양에서, c-kit 활성의 억제는 세포증식을 감소시키며, c-kit-의존적 악성병변의 치료에 있어서 c-kit의 약리적 억제제 용도에 대한 역할을 시사한다(925면 왼쪽 칼럼 2번째 단락 ~ 오른쪽 칼럼 1번째 단락). 우리는 또한 항상적으로 활성화된 c-kit 폴리펩타이드를 발현하는 비만세포 백혈병 세포주(HMC-1)를 사용하여 유사연구를 실시하였다. STI571은 야생형 수용체의 리간드 의존적 활성화에 대한 것보다 이러한 돌연변이 수용체의 키나제 활성에 대하여 강한 억제효과를 나타내었다. 우리는 STI571이 c-kit 키나제 활성의 강력한 억제제이고, 세포증식 또는 생존을 위해 c-kit에 부분적으로 또는 완전히 의존하는 종양들의 치료에 유용할 수도 있다고 결론을 내렸다(920면 오른쪽 칼럼 아래에서 1 ~ 8행). c-kit의 활성화 돌연변이는 몇몇 유형의 인간의 악성질환에서 발견되었으며 이에는 비만세포증(mastocytosis), 비만세포 백혈병, AML, GIST 그리고 정상피종 및 난소정상피종 종양이 포함된다. 이러한 돌연변이는 c-kit 폴리펩타이드의 세포질 부분의 2개의 별개 영역, 즉 막근접 영역(juxtamembrane domain)과 키나제 영역에서 발생한다. 돌연변이는 리간드-비의존적 항상적 키나아제 활성화를 초래한다. STI571은 키나아제 영역과 결합하는 아데노신삼인산염(ATP, adenosine triphosphate)의 경쟁적 억제제로서 기능한다; 그러므로 수용체 구조 또는 기능을 변화시키는 돌연변이가 c-kit 키나아제 활성에 대한 STI571의 억제 효과를 없앨 수도 있다(926면 오른쪽 칼럼 3번째 단락). c-kit는 비만세포종(mastocytosis), 비만세포 백혈병, 고환암, 소세포폐암, GIST, AML, 신경아세포종, 흑색종 및 유방암을 포함하는 다양한 인간 종양의 생태병리학적 기전에 관련되었다. 악성세포에서 c-kit 활성화의 2가지의 일반적 기전은 ① SLF에 의한 수용체의 자가분비, 측분비 자극, 그리고 ② 활성화 돌연변이의 획득으로 설명되었다. c-kit의 자가분비 또는 측분비 자극은 신경아세포종 및 소세포폐암을 포함하는 일부 인간 암에서 관찰되었다(930면 왼쪽칼럼 3번째 단락 및 4번째 단락의 1 ~ 3행). c-kit의 활성화 돌연변이는 인간 비만세포 질환들, 고환종 및 GIST의 경우 에서 설명되었다. 비만세포 질환들 및 GIST에 대하여, c-kit 돌연변이의 존재, 돌연변이의 유형, 또는 두 가지 모두, 임상 예후적으로 중요성을 가지고 있다. 흥미롭게도, 이 종양들은 조직형 세포(비만세포, 생식세포와 간질세포)에서 발생하며, 이 조직형 세포의 발달은 SLF c-kit 축의 활성에 좌우된다.사실, 이 세포들은 SLF 또는 c-kit의 돌연변이를 비활성화시킨 생쥐에는 없다. 이 조직에서 종양이 발달하려면 c-kit의 돌연변이, 또는 c-kit 신호전달의 다운스트림 작용인자를 활성화시키는 대안이 필요할 수 있다(930면 왼쪽 칼럼 5번째 단락 ~ 오른쪽 칼럼 1번째 단락). 약리학적인 c-kit의 억제는 활성화된 c-kit 수용체의 활성에 부분적으로 또는 완전히 좌우되는 악성종양의 치료를 위한 잠재적인 새로운 접근법이다. 고환종을 위한 현행 의학적 치료법은 대부분의 환자에 대하여 치유력이 있지만, 진행된 비만세포 질병, 재발성 또는 전이성 GIST 환자를 위한 효과적인 의학적 치료법은 없다. 사실 GIST에 대한 1999년에 시술된 화학요법을 후향적으로 검토한 결과 반응률이 10% 미만인 것으로 밝혀졌다(930면 오른쪽 칼럼 2번째 단락). 우리는 HMC-1 세포주를 사용하여 돌연변이 형태의 c-kit의 키나제 활성을 억제하는 STI571의 능력을 시험하였다. 이 인자-비의존적 세포주는 원래 비만세포 백혈병 환자에서 유래하였고, 항상적으로 활성화된 c-kit 단백질을 발현한다. … 수용체 활성화에 대한 STI571의 효과는 야생형 c-kit 수용체가 표적으로서 사용되었을 때 관찰된 것보다 더 강력하다. 이러한 특별한 c-kit 돌연변이가 실제로 화합물에 의한 억제에 대해 키나제 영역의 민감성을 증가시키는 것인지, 아니면 관찰된 키나제 민감성의 차이가 예를 들면 그 화합물의 차별적 세포 흡수와 같은, 관련이 없는 인자로부터 비롯된 것인지의 여부는 알 수 없다(930면 오른쪽 칼럼 3번째 단락). 이 연구에 기초하여, 우리는 STI571이 증식 또는 생존을 위하여 야생형 또는 돌연변이 c-kit의 활성에 완전히 또는 부분적으로 좌우되는 악성종양의 치료에 유용할지도 모른다고 생각한다. STI571은 만성 골수성 백혈병(CML) 환자를 치료하기 위한 I상 및 II상 임상 시험에서 효과적이었고, 환자들이 잘 견뎌내었다. 이들 시험에서 1μmol/L의 최저 농도는 환자에서 쉽게 수득되었으며, 이러한 농도의 STI571은 c-kit의 억제에 대한 IC50의 경우보다 더 많은 양이다(B. Druker, 미발표 데이터, 2000년 3월). 추가 연구는 인간 암 치료를 위한 새로운 전략으로서 c-kit 키나제 활성의 억제의 잠재적 효능을 결정하기 위하여 보장되어야 한다(930면 오른쪽 칼럼 4번째 단락). 3) 선행발명 3(갑 제32호증) 1999. 1. 28. 공개된 국제 공개특허공보 제99/3854호에 게재된 “N-페닐-2-피리미딘아민 유도체의 변형 결정체, 그의 제조방법 및 그의 용도(CRYSTAL MODIFICATION OF A N-PHENYL-2-PYRIMIDINEAMINE DERIVATIVE, PROCESSES FOR ITS MANUFACTURE AND ITS USE)”에 관한 발명이다. 4) 선행발명 4(갑 제8호증, 히로타 논문) 1998. 1. 발행되고 세이이치 히로타(Seiich Hirota) 등이 작성한 ‘Science, Vol. 279, 577 ~ 580면’에 게재된 “인간 위장관 기질 종양 내c-kit의 기능획득 돌연변이(Gain-of-Function Mutations of c-kit in Human Gastrointestinal Stromal Tumors)”라는 제목의 논문으로, 그 주요 내용은 다음과 같다. 위장관 기질 종양(GIST)은 인간 소화관에서 가장 일반적인 중간엽 종양이지만, 이들의 분자 병리학 및 세포 기원은 알려져 있지 않다. 5가지 GIST로부터 원발암유전자(proto-oncogene) 수용체 티로신 키나아제(KIT)를 인코딩하는 c-kit 상보적 DNA를 서열분석하여 막관통(transmembrane) 도메인과 티로신키나아제 도메인 사이 영역에 돌연변이들이 드러났다. 해당하는 돌연변이 KIT단백질은 모두 KIT 리간드인 줄기세포 인자(SCF) 없이도 항상(constitutively)활성화된 상태였다. 돌연변이체 c-kit 상보적 DNA의 안정적인 전달감염은 Ba/F3 설치류 림프계 세포의 암성 형질전환을 유도하여, 돌연변이가 종양 발생에 기여함을 제시하였다. 간질세포(ICC)의 발생이 CF-KIT 상호작용에 의존하며, GIST와 마찬가지로 이들 세포가 KIT와 CD34를 둘 다 발현하기 때문에, GIST는 Cajal 간질세포(ICC)에서 발생되어질 수 있다(577면 요약). 293T 인간 배아 신장(HEK) 세포주 내로 돌연변이체 c-kit cDNA를 일시적으로 도입함으로써 GIST에서 확인된 c-kit 돌연변이가 c-kit 수용체 티로신키나아제의 항상적 활성화를 일으킬 것인지 여부를 검사하였다. 야생형 c-kit cDNA를 음성 대조군으로서 도입하였으며, HMC-l 인간 비만세포 백혈병 세포주에서 확인되는 티로신 키나아제 도메인 돌연변이체 및 막근처 도메인 돌연변이체를 양성 대조군으로 도입하였다. 야생형 KIT는 재조합 인간(rh) SCF를 배양 배지에 첨가했을 때에만 티로신이 인산화되었다. 대조적으로, HMC-l세포에서 확인되는 기능획득 KIT 돌연변이체는 앞서 보고된 바와 같이 rhSCF의 첨가 없이 티로신이 인산화되었다. 항상적인 티로신 인산화의 정도는 막근처 도메인 돌연변이체에서보다 티로신 키나이제 도메인 돌연변이체에서 더 컸다. GIST에서 확인된 c-kit 돌연변이체는 또한 rhSCF 없이 293T 세포에서 항상적 티로신 인산화를 보여 주었다. HMC-l 세포의 막근처 돌연변이체의 항상적 티로신 인산화는 GIST의 막-근처 돌연변이체의 인산화와 비슷한 정도를 나타내었다. 시험관 내 키나아제 분석에서, GIST에서 확인된 c-kit 돌연변이체는 HMC-l 세포의 믹-근처 도메인 돌연변이체와 유사한 정도의 항상적 키나아제 활성화를 나타내었다(578면 3번째 칼럼 2단락 내지 579면 3번째 칼럼1단락). 돌연변이체 c-kit의 생물학적 영향을 조사하기 위해, 본 연구진은 GIST에서 확인된 c-kit 돌연변이를 마우스 c-kit cDNA로 도입한 후 인터류킨3(IL-3) 의존성 Ba/F3 설치류 림프계 세포주 내로 cDNA를 안정적으로 전달 감염하였다. 대조군으로 마우스 야생형 c-kit cDNA를 Ba/F3 세포 내로 전달 감염하였다. MTT 비색측정 분석을 이용하여 Ba/F3 세포 증식을 평가하였다. 야생형 설치류 c-kit를 갖는 Ba/F3 세포는 재조합 마우스(rm) IL-3 또는 rmSCF 중 어느 하나의 존재 중에 성장하였다; 돌연변이된 설치류 c-kit를 갖는 Ba/F3 세포는 rmIL-3 및 rrnSCF 없이 스스로 성장하였다. 돌연변이된 설치류 c-kit를 갖는 Ba/F3 세포는 또한 누드마우스에서 스스로 성장하였다. 5개 GIST에서 확인된 전체 KIT 돌연변이체의 항상적 키나아제 활성화가 Ba/F3 세포에서 확인되었다(579면 3번째 칼럼 2단락 ~ 580면 첫 번째 칼럼 1단락). 조혈 줄기세포를 포함하는 다양한 세포가 KIT 및 CD34를 둘 다 발현하지만, ICC는 인간의 정상 위장관(GI) 벽에서 KIT 및 CD34에 대해 이중 양성인 유일한 세포이다. 비록 ICC와 GIST가 다능 조혈 줄기세포에서 관찰되는 것과 같이 단순히 공통적인 미분화 특징을 나타낼 가능성을 배제할 수 없지만, 이는 KIT 및 CD34 이중 양성 GIST가 ICC에서 유래할 수 있다는 것을 강력히 시사한다(580면 첫 번째 칼럼 2단락). KIT가 항상 활성화되는 기전은 티로신 키나아제 도메인 돌연변이체와 막근처 도메인 돌연변이체가 상이한 것으로 나타난다. 전자는 이량체의 형성 없이 항상 활성화된 반면, 후자는 SCF 결합 없이 항상 이량체화한다. KIT의 티로신 키나아제 도메인 돌연변이는 비만세포 신생물에서만 발견되며, 그 막근처 도메인 돌연변이는 GIST에서만 발견된다. 이러한 상이한 돌연변이체가 상이한 세포의 악성 형질전환을 야기하는 기전에 대한 조사가 필요하다(580면 첫번째 칼럼 3단락). [인정근거] 다툼 없는 사실, 갑 제1 내지 3, 8 내지 10, 32호증, 변론 전체의 취지 |
| 원고의 주장요지 | 선행발명 1은 우선일인 2000. 10. 27. 이전에 국내에서 공지되거나 반포된 간행물에 기재된 것이 아니어서 이 사건 특허발명의 진보성을 부정하는 선행발명이 될 수 없고, 이 사건 제2, 4, 5항 발명은 선행발명 1, 2에 의해 신규성이 부정되지 아니하며, 이 사건 제2, 4, 5, 6항 발명은 선행발명 1 내지 3에 의해 진보성이 부정되지 아니함에도, 이와 달리 선행발명 1 내지 3에 의하여 이 사건 제 2, 4, 5, 6항 발명의 진보성이 부정된다고 보아 그 등록을 무효라 고 판단한 이 사건 심결은 위법하다. |
| 이 사건 심결의 당부에 대한 판단 | 가. 선행발명 1(싱어 논문)의 선행기술로서의 적격 여부 이 사건 특허발명의 우선일인 2000. 10. 27. 당시 시행되던 구 특허법(2001. 2. 3. 법률 제6411호로 개정되기 전의 것) 제29조 제1항에 의하면 출원 전에 국내에서 공지되었거나 공연히 실시된 발명 또는 출원 전에 국내 또는 국외에서 반포된 간행물에 기재된 발명에 한하여 출원발명의 신규성과 진보성을 부정할 수 있는 선행기술이 된다. 그리고 을 제8호증, 을나 제12호증에 변론 전체의 취지를 더하여 인정되는 아래 사실에 비추어 보면, 선행발명 1은 2000. 10. 17.경 위 The Lance Oncology 사이트를 통해 국내 누구에게나 공지되었다고 볼 것이어서, 이 부분에 관한 원고의 주장은 이유 없다. 1) ‘The Lancet Oncology'는 2000. 9.부터 매달 정기적으로 임상 암 전문가 관련 저널을 제공하는 출판사이고, 출간에 앞서 온라인판을 먼저 제공하고 있다. 2) 전 세계 웹 사이트의 이미지 정보를 저장해 놓은 사이트인 아카이브(http://www.archive.org)를 통해 확인되는 2000. 10. 17.자 The Lancet Oncology의 인터넷 사이트 이미지 정보에 위 The Lancet Oncology 10월호가 2000. 10. 1. 발간된 것으로 기재되어 있고, 위 10월호의 내용 중 선행발명 1의 본문이 무료로 제공되고 있는 것으로 기재되어 있다. 3) 위 아카이브 사이트의 이미지 정보가 사후에 조작될 가능성이 거의 없다. 4) 국내에서 2000. 10. 17.경 The Lance Oncology 사이트에 대한 접근이 가능하였다. 나. 사건 제2, 4, 5항 발명의 신규성 유무에 대한 판단 1) 청구범위의 분석 이 사건 제2항 발명은 유효성분인 ‘4-(4-메틸피페라진-1-일메틸)-N-[4-메틸-3-(4-피리딘-3-일)피리미딘-2-일-아미노)페닐]-벤즈아미드 또는 그의 약제학적으로 허용되는 염’의 ‘위장관의 기질 종양 치료용’의 의약용도를 청구하는 발명이고, 이 사건 제4항 및 제5항 발명은 유효성분인 ‘4-(4-메틸피페라진-1-일메틸)-N-[4-메틸-3-(4-피리딘-3-일)피리미딘-2-일-아미노)페닐]-벤즈아미드’를 그 산 부가염, 더 나아가 그 산 부가염이 메탄설폰산염인 것으로 한정한 것이다. 한편, 선행발명 1, 2에서는 ‘선택적인 티로신 키나제 억제제(selective tyrosine kinase inhibitor)’인 ‘STI571’에 관하여 기재하고 있는데, ‘STI571’은 ‘CGP 57148B’라고도 불리고(갑 제9호증 925면 초록 1행 등 참조), ‘CGP57148B’는 ‘CGP 57148’의 메탄설폰산염이며(을라 제6호증 100면 우측 칼럼‘Materials' 1행 참조), ’CGP 57148‘은 이 사건 제2항 발명의 유효성분인‘4-(4-메틸피페라진-1-일메틸)-N-[4-메틸-3-(4-피리딘-3-일)피리미딘-2-일-아미노)페닐]-벤즈아미드’와 동일한 화학구조식의 화합물이다(을라 제6호증 101면 좌측 칼럼 도 1 CGP 57148의 구조 참조). 결국 ‘STI571’은 ‘4-(4-메틸피페라진-1-일메틸)-N-[4-메틸-3-(4-피리딘-3-일)피리미딘-2-일-아미노)페닐]-벤즈아미드’의 메탄설폰산염 형태로서, ‘STI571’은 이 사건 제2, 4, 5항 발명의 유효성분을 모두 포괄하는 것이므로, ‘STI571’의 ‘위장관의 기질 종양 치료용’의 의약용도가 선행발명 1, 2에 의하여 구체적으로 개시되었는지 여부에 의해 이 사건 제2, 4, 5항 발명의 신규성 유무가 결정된다. 2) 선행발명 1(싱어 논문)에 의한 신규성 부정 여부 가) 선행발명 1의 기재 내용 선행발명 1에는 ‘STI571’과 관련하여 ‘다른 새로운 접근법들은 화학요법 저항성인 것으로 악명 높은 위장관 기질 종양에서 항상적으로 활성화된 c-kit 수용체 티로신 키나제와 같은 합리적인 타겟을 포함한다. 본 글을 쓸 때, GIST에 대해 선택적 티로신 키나제 억제제인 STI571의 시험이 다나-파버(Dana-Farber) 암 연구소(다른 세계적인 연구 센터와 협력 하에)에서 막 시작되었고 매우 초기 결과는 흥미로워 보인다(very early results look exciting)‘라고 기재되어 있다. 나) 신규성 부정 여부 살피건대, 선행발명 1의 위 기재에 의하면, ‘위장관 기질 종양에서 항상적으로 활성화된 c-kit 수용체 티로신 키나제’를 합리적인 타깃으로 하여, GIST 환자를 대상으로 ‘STI571’의 유효성 확인을 위한 임상시험이 바로 그 때시작되었음을 알 수 있고, 환자를 직접 대상으로 하여 위 임상시험이 임상 매우 초기 결과가 흥미로워서 후속 결과가 기대되는 상황임을 알 수 있다. 그러나 이러한 선행발명 1의 위 기재가 ‘STI571’이 GIST 환자에게 시험적으로 적용되고 있다는 사실을 알려주는 것을 넘어, ‘STI571’이 GIST 환자에게 유효하게 작용하고 있다는 사실을 나타내는 것이라고 단정하기 어려우므로, 선행발명 1에 ‘STI571’의 ‘위장관의 기질 종양 치료용’의 의약용도가 구체적으로 개시된 것이라고 볼 수 없다. 따라서 선행발명 1에 의해 이 사건 제2, 4, 5항 발명의 신규성이 부정된다고 할 수 없다. 다) 피고들의 주장에 대한 판단 이에 대해 피고들은, 선행발명 1은 GIST 치료의 합리적인 타깃으로 비정상적으로 활성화된 ‘c-kit 수용체 티로신 키나제’ 를 제시하고 있어‘STI571’의 GIST 치료 약리기전이 선행발명 1에 실질적으로 개시된 것이고, 유효성 확인을 위한 임상시험을 한다는 것 자체가 GIST에 대한 효과가 강하게 예상된 것이었음을 의미할 뿐만 아니라, “매우 초기 결과”는 매우 빠른 시기에 약효가 나타났음을 의미하고, “대단히 흥미로워 보인다”는 것은 매우 긍정적인 결과가 나타났음을 의미하므로, 그 유효성이 선행발명 1에 실질적으로 개시된 것이라고 주장한다. 그러나 GIST 치료의 합리적인 타깃으로 비정상적으로 활성화된 c-kit(수용체 티로신 키나제)가 제시되어 있었다고 하더라도 이 사건 특허발명의 우선일 이전에 그와 같은 제안이 GIST 모델이나 환자를 대상으로 하여 확인된 바가 없었던 점, ‘STI571’이 GIST 치료에 효과를 보임으로써 비로소 c-kit(수용체 티로신 키나제)와 관련된 GIST 병리기전 및 치료 약리기전이 확립된 것으로 보이는 점, 통상적으로 기본적인 약효실험을 근거로 임상시험승인절차 등을 거쳐 인간을 대상으로 한 임상시험에 들어가지만 그 성공확률이 11%(항암제는5% 이하)로서 높지 않다는 점(갑 제24호증, 711면 세 번째 칼럼 마지막 단락~ 712면 첫 번째 칼럼 1단락 참조), 선행발명 1에는 조기 임상시험에서 유망한 결과를 나타낸 것으로 ET-743과 지방육종에 대한 임상시험에서 특히 유망한 것으로 로지글리타존도 기재되어 있지만 두 약물이 결국에는 바람직한 약효를 보이지 못했다는 점(갑 제25, 27호증의 각 ‘요약’ 참조), 브로스탈리신(brostallicin)은 임상 1상에서 1명의 GIST 환자에게 부분적으로 효과를 보여 임상 2상을 진행하였지만, 임상 2상 단계에서 GIST 환자 집단에 치료 효과가 없는 것으로 판명되어 임상시험이 중단되었다는 점(갑 제46호증 313면 오른쪽 칼럼 아래에서 5 ~ 10행 참조), 임상시험은 통상적으로 일정기간 여러 환자들을 대상으로 진행되는데 초반부에 약이 잘 듣는 환자들이 몰려오기도 하지만, 전체적으로 안듣는 것으로 결론이 날 수도 있고, 초반부에는 별로 효과가 없는 것으로 보였는데 중반기 이후부터 약이 듣는 환자들이 시험에 참여하는 경우도 있어서 초기 결과만으로 특정 약물의 효과를 판단하기 어려운 점(증인 류민희의 증언 참조) 등을 고려해 보면, 선행발명 1의 “매우 초기 결과는 흥미로워 보인다”라는 등의 기재가 ‘STI571’의 ‘위장관의 기질 종양 치료용’의 의약용도를 구체적으로 개시한 것이라고 보기 어렵다. 따라서 피고들의 위 주장을 받아들이지 아니한다. 3) 선행발명 2(하인리히 논문)에 의한 신규성 부정 여부 가) 선행발명 2의 기재 내용 선행발명 2에는 ‘STI571’과 관련하여 “만성 골수성 백혈병의 치료를 위한 임상 시험에서 평가가 진행 중”이고, “PDGFR(platelet-derived growthfactor receptor, 혈소판 유래 성장인자 수용체)과 구조적으로 유사한 수용체인 c-kit의 티로신 키나제 활성의 억제력 시험을 통해 STI571의 활성 프로파일을 연장”하고자 하며, “STI571은 야생형 수용체(M-07e 세포주)의 리간드 의존적 활성화에 대한 것보다 돌연변이형 수용체(HMC-1 세포주)의 키나제 활성화에 대하여 강한 억제효과를 가졌다. 이러한 소견은 STI571이 세포증식 및 생존에 관여하는 목표 단백질의 c-kit 티로신 키나제 활성 및 후속의 활성화를 선택적으로 억제한다는 것을 보여준다. 이 화합물은 c-kit 키나제 활성의 증가와 연관된 암을 치료함에 있어서 유용할 수도 있을 것이다”라고 기재되어 있고, GIST 질환과 관련하여 “비만세포 질환들 및 GIST에 대하여, c-kit돌연변이의 존재, 돌연변이의 유형, 또는 두 가지 모두, 임상 예후적으로 중요성을 가지고 있다”라는 등으로 기재되어 있다. 나) 신규성 부정 여부 살피건대, 선행발명 2의 위 기재에 의하면, STI571은 c-kit 티로신 키나제의 활성을 억제하는 것으로 나타났는데, 성장인자 의존형 c-kit 티로신 키나제에 대한 것보다 돌연변이형 c-kit 티로신 키나제에 대한 억제 활성이 더 강하게 나타났으며, STI571은 c-kit 키나제 활성의 증가와 연관된 암을 치료함에 있어서 유용할 것으로 예측되고, 돌연변이형 c-kit 티로신 키나제 활성과 관련된 질환으로 GIST가 알려져 있음을 알 수 있으므로, 그러한 기재로부터 ‘STI571’이 GIST 질환의 치료에 유용할 수도 있다는 가능성을 인식할 수도 있다. 그러나 ‘STI571’의 c-kit 티로신 키나제 억제 활성에 사용하고 있는 세포주는 M-07e 세포주(인간의 골수성 백혈병 세포주) 및 HMC-1 세포주(비만세포백혈병 환자 유래 세포주)로서, GIST 관련 세포주가 아니고, 구성 아미노산의 위치와 유형의 작은 변경에도 그에 따른 단백질의 구조와 기능이 어떻게 변할지 예측이 어렵다는 것이 업계의 기술상식인 점에 비추어 보면, 통상의 기술자가 GIST 관련 세포주 또는 환자를 대상으로 하지 아니한 선행발명 2의 실험내용으로부터 ‘STI571’의 ‘위장관의 기질 종양 치료용’의 의약용도로서의 유효성을 자명하게 알 수는 없으므로, 선행발명 2에 ‘STI571’의 ‘위장관의 기질 종양치료용’의 의약용도가 구체적으로 개시된 것이라고 볼 수 없다. 따라서 선행발명 2에 의해 이 사건 제2, 4, 5항 발명의 신규성이 부정된다고 할 수 없다. 다) 피고들의 주장에 대한 판단 이에 대해 피고들은, 선행발명 2는 백혈병 치료제 그 자체를 연구하는 것이 아니라, ‘STI571’의 신규활성을 탐색하여 그것의 제2 의약용도를 제공하는 것이 목적으로서 ‘STI571’이 c-kit 활성에 의존하는 악성 종양의 치료에 유용할 수 있다고 결론짓고 있고, ‘STI571’은 야생형에서의 리간드 의존적 활성화보다는 돌연변이 c-kit 활성화 세포에서 더 강한 억제효과를 가지는데, c-kit의 돌연변이에 의한 활성화는 인간 비만세포장애, 고환종 및 GIST에서 설명되고, 특히 비만세포장애 및 GIST에 대하여 c-kit 돌연변이의 존재 및 그 유형이 임상 예후적인 중요성을 가지고 있다고 개시되어 있으므로, 통상의 기술자는 선행발명 2에 기초하여 ‘STI571’의 GIST 치료용도를 직접적으로 인식하거나, 적어도 어려움 없이 도출해 낼 수 있어서, 이 사건 특허발명은 선행발명 2에 실질적으로 개시된 것이라고 주장한다. 살피건대, 선행발명 2에는 “STI571이 c-kit 키나제 활성의 강력한 억제제이고, 세포증식 또는 생존을 위해 c-kit에 부분적으로 또는 완전히 의존하는 종양들의 치료에 유용할 수도 있다”고 기재되어 있고(갑 제9호증 925면 오른쪽 칼럼 아래에서 1 ~ 3행), “c-kit는 비만세포종(mastocytosis), 비만세포 백혈병, 고환암, 소세포폐암, GIST, 급성 골수성 백혈병(AML), 신경아세포종, 흑색종 및 유방암을 포함하는 다양한 인간 종양의 생태병리학적 기전에 관련되어 있다”고 기재되어 있지만(갑 제9호증 930면 왼쪽 칼럼 3번째 단락 1 ~ 4행), 실제로 c-kit가 활성화된 질환 중 GIST를 제외한 대부분 질환이‘STI571’에 효과적으로 반응하지 않았다는 점(갑 제17 내지 21호증 등 참조), 선행발명 2는 GIST 관련 세포주 또는 환자를 대상으로 한 실험이 아니라는 점에서 선행발명 2에 ‘STI571’의 ‘위장관의 기질 종양 치료용’의 의약용도가 구체적으로 개시된 것으로 볼 수 없다. 따라서 피고들의 위 주장을 받아들이지 아니한다. 다. 이 사건 제2, 4, 5, 6항 발명의 진보성 유무에 대한 판단 1) 암 치료제 의약용도발명에서의 진보성 판단기준 암 치료 의약 분야는 사람의 생명현상을 다루는 고난이도의 결과 예측이 매우 어려운 기술분야이고, 암의 발병 원인이 복잡하고 아직 완전히 밝혀지지 않았으며, 동물 모델 실험이나 실험실에서의 세포주 실험 결과를 근거로 사람에게 임상실험을 하더라도 전혀 다른 결과가 나올 수 있는 분야이다. 또한, 암은 다수의 유전자 돌연변이 가지는데, 하나의 유전자 돌연변이를 표적으로 하는 암 치료제 개발의 성공 확률도 매우 낮고 암 치료제 개발에 막대한 비용과 시간이 든다. 이러한 암 치료제 개발의 특수성을 고려하면 통상의 기술자가 선행발명으로부터 암 치료 의약용도 발견의 가능성을 예상할 수 있다는 것을 넘어 선행발명으로부터 암 치료 의약용도 발견의 성공에 대해 합리적으로 기대할 수 있는 경우에만 선행발명에 의해 암 치료제 의약용도발명의 진보성이 부정된다. 2) 구체적인 판단 다음과 같은 이유로 통상의 기술자가 선행발명 1, 2로부터 ‘STI571’의 ‘위장관의 기질 종양 치료용’의 의약용도 발견을 성공하리라고 합리적으로 기대할 수 있다고 할 수 없고, 따라서 이 사건 제2, 4, 5항 발명은 통상의 기술자가 선행발명 1, 2에 의해 쉽게 발명할 수 없으므로 그 진보성이 부정되지 않는다. 가) 이 사건 특허발명의 우선일 이전에 GIST의 병리기전 내지 치료기전이 c-kit와 관련된 것으로 밝혀져 있는지 여부 이 사건 특허발명의 배경기술인 선행발명 4(히로타 논문)는 GIST 환자의 종양조직으로부터 분리한 c-kit 단백질을 발현하는 유전자를 서열분석한 결과, c-kit의 막근처(juxtamembrane) 도메인에서 돌연변이가 있음을 발견했는데, 이들 돌연변이 단백질은 줄기세포인자(SCF) 없이도 항상적으로 활성화 된 상태였고, 돌연변이체 c-kit cDNA의 안정적인 전달 감염은 Ba/F3 설치류 림프계 세포의 암성 형질전환을 유도하였으므로, 위 돌연변이가 종양 발생에 기여함을 제시하고 있다(갑 제8호증 577면 요약 참조). 또한 선행발명 4에는 막근처 도메인 돌연변이체인 HMC-l 세포주를 대조군으로 하여 GIST 돌연변이체와 비교하고 있는데, HMC-l 세포주는 GIST 돌연변이체와 유사한 정도의 항상적 키나아제 활성화를 나타낸 것으로 기재되어 있다(갑 제8호증 579면 세번째 칼럼 1단락 참조). 이러한 선행발명 4 및 이를 인용하고 있는 선행발명 2 등에 의하면, 이 사건 특허발명의 우선일 이전에 적어도 c-kit 돌연변이가 GIST의 병리기전의 하나임이 업계에 어느 정도 인식되어 있었다고 보인다. 그러나 다른 문헌들에는,“TGF-α/EGFR 자가분비 루프(autocrine loop)가 GIST에 존재하고 이를 표적으로 하는 것이 GIST 치료에 이로울 수 있다”고 기재되어 있고(갑 제12호증 114면 오른쪽 칼럼 2번째 단락 14 ~ 16행), “12/24 악성 GIST 및 잠재적 악성 GIST에서 c-kit 돌연변이가 없는 것으로부터, c-kit 엑손11의 돌연변이가 암발생 및 악성 종양과 관련된 유일한 메커니즘은 아니며, 양성 GIST 및 악성 GIST간의 차이점을 설명하는 다른 분자메커니즘이 존재하여야 함을 시사한다”고 기재되어 있다(갑 제13호증 58면 오른쪽 칼럼 아래에서 2 ~ 7행 참조). 이러한 기재 내용과 암은 복잡한 발암과정을 거쳐 생성되는 것으로 중요한 병리기전을 여러 개 가지고 있는 것이 일반적인데다 어느 신호경로를 차단하여도 복잡하게 얽힌 다른 신호경로를 통해 계속 증식하고 생존할 수 있다는 점(갑 제33 내지 37호증 참조) 등을 고려하면, 이 사건 특허발명의 우선일 이전에 GIST의 병리기전 내지 치료기전이 c-kit와 관련된 것으로 밝혀져 있었다고 볼 수 없다. 나) 이 사건 특허발명의 우선일 이전에 c-kit 활성의 억제로 인간 암 치료에 성공한 경우가 있었는지 여부 ‘STI571’이 만성 골수성 백혈병(CML)의 치료제로 사용되어오기는 하였으나, CML은 우선일 당시에 bcr-abl이라는 단백질을 생산하는 bcr-abl 유전자들에 의해 생기는 것으로 잘 알려져 있었을 뿐이었고, 선행발명 1에 “항상적으로 활성화된 c-kit 수용체 티로신 키나제”를 합리적인 타깃으로 하여 GIST에 대한 임상실험이 진행 중이라는 기재는 있었으나, 이 사건 특허발명에 의해 비로소 c-kit 활성의 억제로 인간 암인 GIST 치료의 성공이 발견되었고, 이 사건 특허발명 우선일 이전에 그 치료 성공이 보고된 바가 없다. 다) 선행발명 2에 개시된 ‘STI571’의 HMC-1 세포주에 대한 c-kit 억제활성으로부터 GIST 치료 성공에 대해 합리적으로 기대할 수 있었는지 여부 선행발명 4에 의하면 GIST 환자의 돌연변이체와 그 대조군으로 사용한 HMC-l 세포주는 c-kit의 막근처 도메인의 돌연변이이고, 줄기세포 인자(SCF) 없이도 항상적으로 활성화된 상태를 유지하며, 이러한 항상적 활성화정도가 서로 유사하다는 점에서 공통된다(갑 제8호증 579면 세 번째 칼럼 1단락 참조). 또한 선행발명 2에서도 HMC-l 세포주로 항상적 키나제 활성화를 갖는 막근처 돌연변이 c-kit 폴리펩티드를 발현하는 인자-비의존적 세포주를 사용하고 있는데(갑 제9호증 926면 왼쪽 칼럼 7 ~ 10행 참조), 선행발명 4의 HMC-l 세포주와 선행발명 2의 HMC-l 세포주는 차이가 없는 것으로 보인다. 그러나 선행발명 2, 4에서 HMC-1 세포주는 비만세포 백혈병 환자 유래 세포주로서 GIST 세포주가 아니고, HMC-1 세포주와 GIST 환자의 돌연변이 서열은 서로 일치하지 않으며(갑 제8호증 579면 도 3 참조), 구성 아미노산의 위치와 유형의 작은 변경에도 그에 따른 단백질의 구조와 기능이 어떻게 변할지 예측이 어렵다는 것이 업계의 기술상식이고, 선행발명 2에도 “수용체 구조 또는 기능을 변화시키는 돌연변이가 c-kit 키나아제 활성에 대한 STI571의 억제효과를 없앨 수도 있다”고 기재되어 있으며(갑 제9호증 926면 오른쪽 칼럼 3번째 단락의 9 ~ 11행), 이 사건 특허발명의 우선일 이전 GIST의 병리기전 내지 치료기전이 c-kit와 관련된 것으로 밝혀져 있었다고 볼 수 없다는 점에 비추어 볼 때, 선행발명 2에 개시된 내용 즉, ‘STI571’이 HMC-1 세포주에 대한 c-kit 억제를 활성화한다는 것으로부터 ‘STI571’의 GIST 치료 성공을 합리적으로 기대할 수 없다. 라) 선행발명 1에 개시된 ‘STI571’의 GIST에 대한 임상시험 관련 기재로부터 이 사건 특허발명의 성공을 합리적으로 기대할 수 있었는지 여부 선행발명 1로부터 “위장관 기질 종양에서 항상적으로 활성화된 c-kit 수용체 티로신 키나제”를 합리적인 타깃으로 하여 GIST 환자를 대상으로‘STI571’의 유효성 확인을 위한 임상시험이 바로 그 때 시작되었는데, 매우 초기 결과가 흥미로워서 후속 결과가 기대되는 상황임을 알 수 있다. 또한, 선행발명 2에 의하면 ‘STI571’은 CML 환자를 치료하기 위한 I상 및 II상 임상 시험에서 효과적이었고, 환자들이 잘 견뎌내었으므로(갑 제9호증 930면 오른쪽 칼럼 아래에서 7 ~ 8행 참조), 'STI571'의 안전성도 큰 문제가 없는 것임도 알 수 있다. 그러나 선행발명 1이 GIST 질환 치료에 “위장관 기질 종양에서 항상적으로 활성화된 c-kit 수용체 티로신 키나제를 합리적인 타깃”으로 하여 ‘STI571’을 시도하는 것이 최초라고 할 것인데, ‘STI571’을 GIST 환자에게 적용한 결과 발생한 효과의 근거에 대한 언급 없이 단지 ‘매우 초기 결과가 흥미롭다’고 기재한 것만으로 그 유효성을 알 수 없고, 단백질의 돌연변이 차이로 인한 약물의 반응성은 더욱 예측이 어려워 실험적으로 확인하지 않고서는 그 결과를 알기 어려운 점 등을 고려하면, 선행발명 1에 개시된 ‘STI571’의 GIST에 대한 임상시험 관련 기재로부터 이 사건 특허발명의 성공을 합리적으로 기대할 수 있다고 볼 수 없다. 라. 이 사건 제6항 발명의 진보성 유무에 대한 판단 이 사건 제6항 발명은 이 사건 제2항 발명의 종속항으로 ‘STI571’의 투여량을 ‘하루 용량이 200 내지 600mg’인 것으로 한정한 것인데, 이 사건 제2항 발명의 진보성이 부정되지 않는 이상 그 종속항인 이 사건 제6항 발명의 진보성도 부정되지 않는다. 마. 이 사건 심결의 적법 여부 따라서 이 사건 제2, 4, 5항 발명의 신규성과 이 사건 제2, 4, 5, 6항 발명의 진보성이 부정되지 아니하여 이 사건 제2, 4, 5, 6항 발명은 그 등록이 무효로 되어서는 아니되는바, 이 사건 심결은 이와 결론을 달리하여 위법하다. |
| 결론 | 그렇다면 이 사건 심결의 취소를 구하는 원고의 청구는 이유 있으므로 이를 인용하기로 하여 주문과 같이 판결한다. |
[그림 1]

| 번호 | 사건번호 | 제목 | 분야 | 출원번호 | 법원명 | 날짜 | 조회 수 |
|---|---|---|---|---|---|---|---|
| 154 | 2015허4569 등록무효(특) | 2015허4569 등록무효(특) | 특허/실용신안 | 제756225호 | 특허법원 | 2020.06.19 | 65 |
| 153 | 2015허1133 거절결정(특) |
2015허1133 거절결정(특)
|
특허/실용신안 | 제10-2012-31752호 | 특허법원 | 2020.06.18 | 70 |
| 152 | 2015허3450 거절결정(특) |
2015허3450 거절결정(특)
|
특허/실용신안 | 제10-2006-0103794호 | 특허법원 | 2020.06.18 | 64 |
| 151 | 2015허2587 거절결정(특) |
2015허2587 거절결정(특)
|
특허/실용신안 | . | 특허법원 | 2020.06.18 | 101 |
| 150 | 2015허1836 권리범위확인(특) |
2015허1836 권리범위확인(특)
|
특허/실용신안 | 제981761호 | 특허법원 | 2020.06.18 | 91 |
| 149 | 2015허3283 권리범위확인(특) |
2015허3283 권리범위확인(특)
|
특허/실용신안 | 제10-1385449호 | 특허법원 | 2020.06.18 | 62 |
| 148 | 2014허3590 등록무효(특) |
2014허3590 등록무효(특)
|
특허/실용신안 | 제1245919호 | 특허법원 | 2020.06.18 | 75 |
| » | 2014허4913 등록무효(특) |
2014허4913 등록무효(특)
|
특허/실용신안 | 제0885129호 | 특허법원 | 2020.06.18 | 74 |
| 146 | 2014허4418 거절결정(특) | 2014허4418 거절결정(특) | 특허/실용신안 | 제10-2012-46960호 | 특허법원 | 2020.06.17 | 76 |
| 145 | 2015허277 권리범위확인(특) |
2015허277 권리범위확인(특)
|
특허/실용신안 | 제1263620호 | 특허법원 | 2020.06.17 | 63 |
| 144 | 2015허215 권리범위확인(실) |
2015허215 권리범위확인(실)
|
특허/실용신안 | 제451329호 | 특허법원 | 2020.06.17 | 54 |
| 143 | 2014허8441 권리범위확인(실) |
2014허8441 권리범위확인(실)
|
특허/실용신안 | 제466283호 | 특허법원 | 2020.06.17 | 62 |
| 142 | 2015허659 등록무효(특) |
2015허659 등록무효(특)
|
특허/실용신안 | 제10-1378612호 | 특허법원 | 2020.06.17 | 63 |
| 141 | 2015허154 등록무효(특) |
2015허154 등록무효(특)
|
특허/실용신안 | 제1373142호 | 특허법원 | 2020.06.17 | 71 |
| 140 | 2014허7509 권리범위확인(특) |
2014허7509 권리범위확인(특)
|
특허/실용신안 | 제1178877호 | 특허법원 | 2020.06.17 | 52 |
| 139 | 2014허8878 등록무효(실) |
2014허8878 등록무효(실)
|
특허/실용신안 | 제20-365414호 | 특허법원 | 2020.06.17 | 48 |
| 138 | 2014허7325 등록무효(특) |
2014허7325 등록무효(특)
|
특허/실용신안 | 제971555호 | 특허법원 | 2020.06.17 | 34 |
| 137 | 2014허5794 등록무효(특) |
2014허5794 등록무효(특)
|
특허/실용신안 | 제316401호 | 특허법원 | 2020.06.17 | 53 |
| 136 | 2015허3795 등록정정(특) |
2015허3795 등록정정(특)
|
특허/실용신안 | 제10-0707547호 | 특허법원 | 2020.06.17 | 31 |
| 135 | 2015허1256 거절결정(특) |
2015허1256 거절결정(특)
|
특허/실용신안 | 제10-0540033호 | 특허법원 | 2020.06.17 | 64 |