[표]
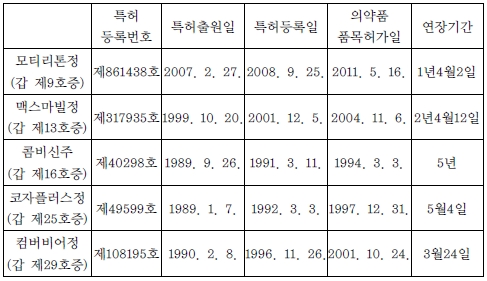
[별지]
관련 법령 및 고시
◈ 구 특허법(2011. 12. 2. 법률 제11117호로 개정된 것)
제89조(허가등에 따른 특허권의 존속기간의 연장) ① 특허발명을 실시하기 위하여 다른 법령의 규정에 의하여 허가를 받거나 등록등을 하여야 하고, 그 허가 또는 등록등(이하 “허가등”이라 한다)을 위하여 필요한 활성․안전성등의 시험으로 인하여 장기간이 소요되는 대통령령이 정하는 발명인 경우에는 제88조제1항의 규정에 불구하고 그 실시할 수 없었던 기간에 대하여 5년의 기간내에서 당해 특허권의 존속기간을 연장할 수 있다.
② 제1항의 규정을 적용함에 있어서, 특허권자에게 책임있는 사유로 소요된 기간은 제1항의 “실시할 수 없었던 기간”에 포함되지 아니한다.
제91조(허가등에 따른 특허권의 존속기간의 연장등록거절결정) 심사관은 제90조에 따른 특허권의 존속기간의 연장등록출원이 다음 각 호의 어느 하나에 해당하는 경우에는 그 출원에 대하여 연장등록거절결정을 하여야 한다.
1. 그 특허발명의 실시가 제89조제1항의 규정에 의한 허가등을 받을 필요가 있는 것으로 인정되지 아니하는 경우
2. 그 특허권자 또는 그 특허권의 전용실시권이나 등록된 통상실시권을 가진 자가 제89조제1항의 규정에 의한 허가등을 받지 아니한 경우
3. 연장신청의 기간이 제89조에 따라 인정되는 그 특허발명을 실시할 수 없었던 기간을 초과하는 경우
4. 연장등록출원인이 당해 특허권자가 아닌 경우
5. 제90조제3항의 규정에 위반하여 연장등록출원을 한 경우
◈ 구 특허법 시행령(2011. 12. 2. 대통령령 제23341호로 개정된 것)
제7조(허가등에 따른 특허권의 존속기간의 연장등록출원 대상 발명) 법 제89조제1항에서 “대통령령이 정하는 발명”이란 다음 각 호의 어느 하나에 해당하는 발명을 말한다.
1. 특허발명을 실시하기 위하여 「약사법」 제31조제2항·제3항 또는 제42조제1항에 따라 품목허가를 받아야 하는 의약품의 발명
2. 특허발명을 실시하기 위하여 「농약관리법」 제8조제1항, 제16조제1항 및 제17조제1항에 따라 등록하여야 하는 농약 또는 원제의 발명
◈ 개정 특허법 시행령(2013. 4. 3. 대통령령 제24491호로 개정된 것)
제7조(허가등에 따른 특허권의 존속기간의 연장등록출원 대상 발명) 법 제89조제1항에서 “대통령령이 정하는 발명”이란 다음 각 호의 어느 하나에 해당하는 발명을 말한다.
1. 특허발명을 실시하기 위하여 「약사법」 제31조제2항·제3항 또는 제42조제1항에 따라 품목허가를 받은 의약품[신물질(약효를 나타내는 활성부분의 화학구조가 새로운 물질을 말한다. 이하 이 조에서 같다)을 유효성분으로 하여 제조한 의약품으로서 최초로 품목허가를 받은 의약품으로 한정한다]의 발명
2. 특허발명을 실시하기 위하여 「농약관리법」 제8조제1항, 제16조제1항 또는 제17조제1항에 따라 등록한 농약 또는 원제(신물질을 유효성분으로하여 제조한 농약 또는 원제로서 최초로 등록한 농약 또는 원제로 한정한다)의 발명
부칙 <대통령령 제24491호, 2013. 4. 3.>
제1조(시행일) 이 영은 공포한 날부터 시행한다.
제2조(허가등에 따른 특허권의 존속기간의 연장등록출원 대상 발명에 관한 적용례) 제7조의 개정규정은 이 영 시행 이후 허가등에 따른 특허권의 존속기간의 연장등록출원을 한 발명부터 적용한다.
◈ 구 약사법(2012. 2. 1. 법률 제11251호로 개정된 것)
제2조(정의) 이 법에서 사용하는 용어의 뜻은 다음과 같다.
8. “신약”이란 화학구조나 본질 조성이 전혀 새로운 신물질의약품 또는 신물질을 유효성분으로 함유한 복합제제 의약품으로서 식품의약품안전처장이 지정하는 의약품을 말한다.
제31조(제조업 허가 등) ① 의약품 제조를 업(業)으로 하려는 자는 대통령령으로 정하는 시설기준에 따라 필요한 시설을 갖추고 총리령으로 정하는 바에 따라 식품의약품안전처장의 허가를 받아야 한다.
② 제1항에 따른 제조업자가 그 제조(다른 제조업자에게 제조를 위탁하는 경우를 포함한다)한 의약품을 판매하려는 경우에는 총리령으로 정하는 바에 따라 품목별로 식품의약품안전처장의 제조판매품목허가(이하 “품목허가”라 한다)를 받거나 제조판매품목 신고(이하 “품목신고”라 한다)를 하여야 한다.
③ 제1항에 따른 제조업자 외의 자가 제34조제1항에 따라 임상시험계획의 승인을 받아 임상시험을 실시한 의약품을 제조업자에게 위탁제조하여 판매하려는 경우에는 총리령으로 정하는 바에 따라 식품의약품안전처장에게 위탁제조판매업신고를 하여야 하며, 품목별로 품목허가를 받아야 한다.
⑩ 제2항 및 제3항에 따라 허가를 받거나 신고하려는 품목이 신약 또는 식품의약품안전처장이 지정하는 의약품인 경우에는 안전성·유효성에 관한 다음 각 호의 자료를 총리령으로 정하는 바에 따라 제출하여야 한다. 다만, 제2호는 제31조의2에 따라 원료의약품을 등록한 경우는 제외한다.
1. 시험성적서와 그에 관한 자료
2. 원료의약품에 관한 자료
3. 관계 문헌
4. 그 밖에 필요한 자료
제42조(의약품등의 수입허가 등) ① 의약품등을 수입하려는 자(이하 “수입자”라 한다)는 총리령으로 정하는 바에 따라 품목마다 식품의약품안전처장의 허가를 받거나 신고를 하여야 한다. 허가받은 사항 또는 신고한 사항을 변경하려는 경우에도 또한 같다.
◈ 한약(생약)제제 등의 품목허가·신고에 관한 규정 [시행 2011. 9. 19.] [식품의약품안전청고시 제2011-54호, 2011. 9. 19.]
제2조(정의) 이 규정에서 사용하는 용어의 정의는 다음 각 호와 같다.
1. “유효성분”이란 내재된 약리작용에 의하여 그 의약품의 효능·효과를 직접 또는 간접적으로 발현한다고 기대되는 물질 또는 물질군(약리학적 활성성분 등이 밝혀지지 아니한 생약 등을 포함한다)으로서 주성분을 말한다.
5. “신약”이란 「약사법」(이하 “법”이라 한다) 제2조제8호에 따른 의약품으로서 국내에서 이미 허가된 의약품과는 화학구조 또는 본질 조성이 전혀 새로운 신물질의약품 또는 신물질을 유효성분으로 함유한 복합제제 의약품으로서 별표 1의 한약(생약)제제의 제출자료 중 Ⅰ에 해당하는 의약품을 말한다. 다만, 「대한약전」(식약청 고시), 「대한약전외 의약품 기준」(식약청 고시) 또는 「공정서 및 의약품집 범위지정」(식약청 고시)(이하 “공정서”라 한다)에 수재된 품목은 제외한다.
6. “안전성·유효성심사 자료제출의약품(이하 “자료제출의약품”이라 한다)”이란 신약이 아닌 의약품이면서 이 규정에 의한 안전성·유효성 심사가 필요한 품목으로서 별표 1의 한약(생약)제제의 제출자료 중 Ⅱ에 해당하는 의약품을 말한다.
9. “외국임상자료”란 임상시험자료집 중 외국에서 얻어진 임상시험자료를 말한다.
10. “가교자료”란 국내·외에 거주하는 한국인을 대상으로 얻어진 시험자료로서 임상시험자료집에서 발췌하거나 선별한 자료 또는 가교시험으로부터 얻어진 자료를 말한다.
11. “가교시험”란 의약품의 안전성·유효성에 관한 민족적 요인에 차이가 있어 외국임상자료를 그대로 적용하기가 어려운 경우 국내에서 한국인을 대상으로 가교자료를 얻기 위하여 실시하는 시험을 말한다.
13. “외국임상자료의 국내 적용”이란 외국임상자료를 한국인에 대한 의약품의 안전성·유효성 자료로 갈음하는 것을 말한다.
15. “천연물신약”이란 「천연물신약연구개발촉진법」제2조제3호에 따른 의약품으로서 천연물성분을 이용하여 연구·개발한 의약품 중 조성성분·효능 등이 새로운 의약품으로서 별표 1의 한약(생약)제제의 제출자료 중 Ⅰ. 신약 및 Ⅱ. 자료제출의약품의 1.부터 4.까지에 해당하는 의약품을 말한다.
◈ 특허권의 존속기간의 연장제도 운용에 관한 규정(특허청고시 제2009-18호, 2009. 8. 24. 시행)
제1조 (목적) 이 규정은 특허법(이하 “법”이라 한다) 제89조 내지 제93조 및 동법 시행령 제7조, 동법 시행규칙 제52조, 제53조의 규정에 의거 특허권 존속기간 연장등록출원의 심사 및 연장제도 운용에 관한 세부사항을 규정함으로써 출원인의 편의를 도모함을 목적으로 한다.
제2조 (연장받을 수 있는 요건) ① 연장을 받을 수 있는 특허는 특허법 시행령 제7조의 규정에 의한 발명에 대한 것이어야 한다.
② 제1항 특허의 청구범위에는 약사법 제31조 제1항 또는 제42조 제1항의 규정에 의한 허가 또는 농약관리법 제8조 제1항·동법 제16조 제1항 및 제17조 제1항의 규정에 의한 등록을 받은 사항이 포함되어 있어야 한다.
③ 제1항의 특허는 연장등록출원 당시 유효한 것이어야 한다.
제3조 (연장횟수) ① 하나의 특허에 대한 특허권의 존속기간연장은 1회에 한한다.
② 하나의 허가 또는 등록사항에 대하여 복수의 특허가 있는 경우에는 어느 특허권도 그 존속기간의 연장등록을 개별적으로 할 수 있다.
③ 하나의 특허와 관련하여 복수의 허가 또는 등록이 있는 경우에는 그중 최초의 허가 또는 등록에 의한 것만 연장등록이 인정된다.
제7조 (연장등록출원심사요령) ① 심사관은 연장등록출원이 심사국에 이관된 날부터 4월 이내에 제6조제1항제4호의 연장대상 특허청구범위와 법 제89조의 규정에 의한 허가 또는 등록받은 사항을 다음 각호의 1과 같이 비교하여 그 특허발명의 실시에 필수적으로 허가 또는 등록을 받을 필요성이 있는지 여부를 판단한다.
1. 물질의 발명인 경우 허가 또는 등록받은 유효성분과 특허청구의 범위에 기재된 사항(제6조 제1항 제4호의 규정에 따라 예시된 특정화합물)을 비교하여 판단한다. 또한, 허가 또는 등록받은 유효성분이 특허청구의 범위에 명기되어 있지 않아도 당해 유효성분이 특허청구의 범위에 상위개념으로 기재되어 있으면 무방하다.
2. 제법발명인 경우에는 그 제법으로 얻어진 물건(물질, 조성물)과 허가 또는 등록 받은 물건을 비교하여 판단한다.
3. 용도발명인 경우에는 허가 또는 등록된 용도와 특허청구의 범위에 기재 된 용도를 비교하여 판단한다.
4. 조성물의 발명인 경우에는 허가 또는 등록된 조성물(복수의 유효성분의 조성물, 제형, 담체조성물)과 특허청구의 범위에 기재된 조성물을 비교하여 판단한다.
② 심사관은 특허권의 존속기간의 연장등록출원에 대하여 제6조 제1항 각호에 규정된 기재사항 또는 첨부자료가 미비할 경우에는 그 출원인에게 기간을 정하여 보정 지시를 할 수 있다.
③ 심사관은 특허권의 존속기간의 연장등록출원에 대하여 법 제91조 제1항의 규정에 의하여 거절사정을 하고자 할 때에는 그 출원인에게 거절이유를 통지하고 기간을 정하여 의견서를 제출할 수 있는 기회를 주어야 한다.
④ 제3항의 지정기간을 연장하고자 하는 경우 그 연장기간은 1월로 하고 3회에 한하여 연장할 수 있다. 끝.
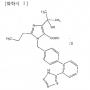 2014허5817 등록무효(특)
2014허5817 등록무효(특)