









| 사건번호 | 2016허4368 거절결정(특) |
|---|---|
| 판례제목 | 2016허4368 거절결정(특) |
| 출원번호 | 2008-7013112 |
| 분야 | 특허/실용신안 |
| 판결일 | 2017-02-10 |
| 법원명 | 특허법원 |
| 원고 | 1. 노파르티스 아게 (Novartis AG) 2. 에르테에스 로만 테라피-시스테메 아게 (LTS LOHMANN THERAPIE-SYSTEME AG) |
| 피고 | 특허청장 |
| 판사 | 박형준, 이혜진, 진현섭 |
| 판결결과 | 거절결정(특) |
| 주문 | 1. 원고들의 청구를 모두 기각한다. 2. 소송비용은 원고들이 부담하다. |
| 청구취지 | 특허심판원이 2016. 4. 15. 2014원1643호 사건에 관하여 한 심결을 취소한다. |
| 기초사실 | 1. 기초사실 가. 이 사건 심결의 경위 1) 원고들의 특허출원에 대해, 특허청 심사관은 2013. 5. 23. ‘이 사건 출원발명은 그 발명이 속하는 기술분야에서 통상의 지식을 가진 사람(이하 ’통상의 기술자‘라 한다)이 선행발명 및 공개특허공보 제10-2001-112452호, 미국 특허출원공개공보 US 2003/152616호로부터 용이하게 발명할 수 있으므로 그 진보성이 부정되고, 명세서 기재 요건을 충족하지 못한 위법이 있으므로 특허를 받을수 없다.‘는 이유로 의견제출통지를 하였다. 2) 이에 원고들은 2013. 11. 25. 의견서와 함께 명세서 등 보정서를 제출하였으나, 특허청 심사관은 2013. 12. 19. 그 보정에도 불구하고 이 사건 출원발명의 청구항 1 내지 10, 13은 여전히 선행발명 등에 의하여 그 진보성이 부정된다는 이유로 이 사건 출원발명에 대한 특허거절결정을 하였다. 3) 원고들은 2014. 3. 19. 특허심판원에 위 거절결정에 대한 불복심판을 청구하였고, 특허심판원은 위 심판청구를 2014원1643호로 심리한 다음, 2016. 4.15. ‘이 사건 제1항 발명은 선행발명 및 공개특허공보 제10-2001-112452호에의하여 진보성이 부정된다.’는 이유로 원고들의 위 심판청구를 기각하는 이 사건 심결을 하였다. 나. 이 사건 출원발명(갑 제1호증) 1) 발명의 명칭 : 경피용 치료학적 시스템 2) 국제출원일/ 우선권주장일/ 번역문제출일 / 출원번호: 2006. 10. 10. /2005.12. 1. / 2008. 5. 30./ 2008-7013112 3) 특허청구범위 【청구항 1】a) 배면층, b) 리바스티그민 및 하나 이상의 중합체를 포함하는 저장층, 및 c) 접착층을 포함하고, 1일 3 mg 초과의 용량으로 리바스티그민을 제공하며 45.6 ± 16.6 ng·h/mL의 AUC24h10)를 제공하는, 치매 또는 알츠하이머병의 예방, 치료, 또는 진행의지연을 위한 출발용량으로 사용하기 위한 경피용 치료학적 시스템 (TTS)11)(이하 ‘이 사건 제1항 발명’이라 한다). 【청구항 2】내지【청구항 13】각 기재 생략 4) 발명의 개요 다. 선행발명(갑 제5호증) 선행발명은 2001. 4. 25. 공개된 공개특허공보 제2001-33072호에 게재된‘항산화제를 함유하는 티티에스’라는 명칭의 발명에 관한 것으로서, 그 명세서에는 다음과 같은 내용이 기재되어 있다. [인정근거] 다툼 없는 사실, 갑 제1 내지 5호증의 각 기재, 변론 전체의 취지 |
| 원고의 주장요지 | 2. 원고들의 주장 요지 가. 이 사건 제1항 발명은 리바스티그민의 경피 투여의 출발용량에 관한 것으로서, 어떤 용량의 TTS를 용량 적정의 출발용량으로 할 것인지를 결정하는 것인 반면, 선행발명은 TTS의 저장 기간 동안 TTS에 함유된 리바스티그민(화합A)이 분해되는 것을 감소시켜서 안정된 제약 조성물을 얻는 것에 관한 것이므로, 이 사건 제1항 발명은 선행발명에 비하여 목적의 특이성이 있다.나. 이 사건 제1항 발명의 경피 투여의 출발용량은 경구 투여의 출발용량에 비해 현저히 높은데(AUC24h를 기준으로 4배), 경피 투여의 출발용량을 경구 투여에 비해 높게 설정하는 것은 다음과 같은 이유로 그 구성의 곤란성이 있으므로,이 사건 제1항 발명의 구성은 선행발명으로부터 용이하게 도출할 수 없다. 1) 이 사건 출원발명의 우선일 당시 경구 제형의 출발용량이 알려진 경우,TTS 용량을 경구 투여 용량이 제공하는 AUC 값과 동등하게 설정하는데 있어서, 동일 약물의 경피 제형은 ‘초회 통과 효과14)’를 회피할 수 있기 때문에 그출발용량은 경구 출발용량보다 낮게 설정하는 것이 일반적이었고, 대표적인 사례로는 클로니딘, 에스트라디올 및 옥시부티닌의 약물이 있다. 특히, 리바스티그민의 경우는 경구 투여시 현저히 큰 ‘초회 통과 효과’와 ‘비선형 약동학적 특성’을 나타내는 것으로 알려져 있었으므로, TTS 출발용량을 높게 설정하면 부작용의 가능성이 높다는 점을 고려할 때, 통상의 기술자는 경구 출발용량인 1일3mg보다 훨씬 낮은 용량이 필요하다고 생각하였을 것이다. 2) 이 사건 출원발명의 우선일 당시 리바스티그민의 위장관 부작용이 Cmax보다 AUC에 더 관련 있다는 것이 당업계의 인식이었으므로, 리바스티그민의 TTS가 경구 제형에 비하여 부작용이 더 낮을 것이라고 기대할 수는 없었을 것이다.다. 이 사건 제1항 발명은 출발용량이 경구 출발용량에 비하여 AUC 값이 4배정도 크지만 부작용은 오히려 더 적게 나타나는데, 이러한 효과는 통상의 기술자가 선행발명으로부터 예측할 수 없는 현저한 효과이다.라. 그렇다면 이 사건 제1항 발명은 선행발명에 의하여 그 진보성이 부정되지아니하므로, 이와 결론을 달리한 이 사건 심결은 위법하여 취소되어야 한다. |
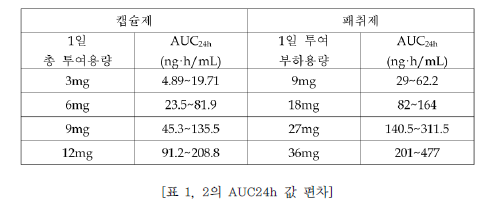
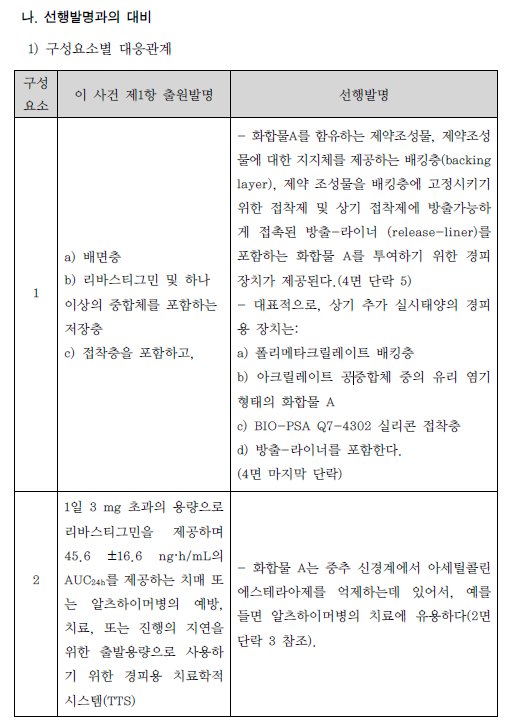
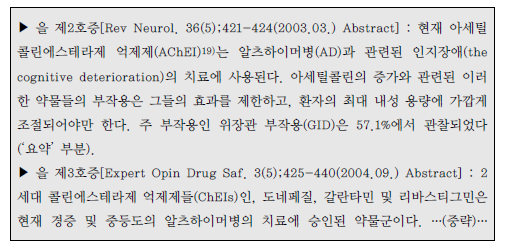
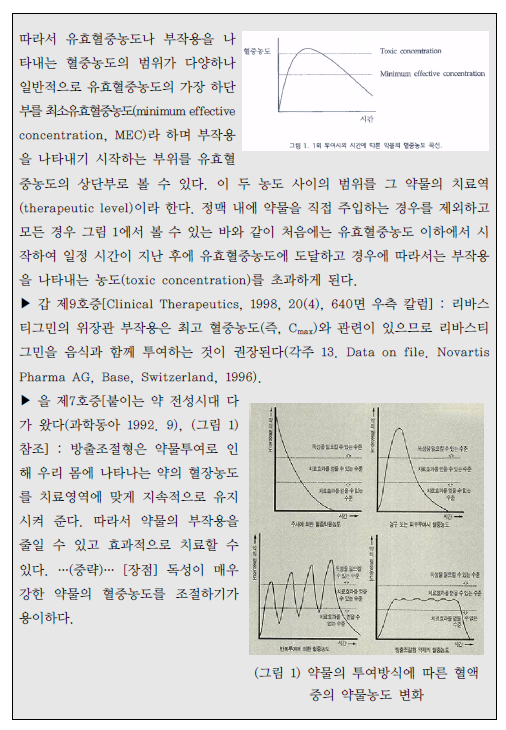
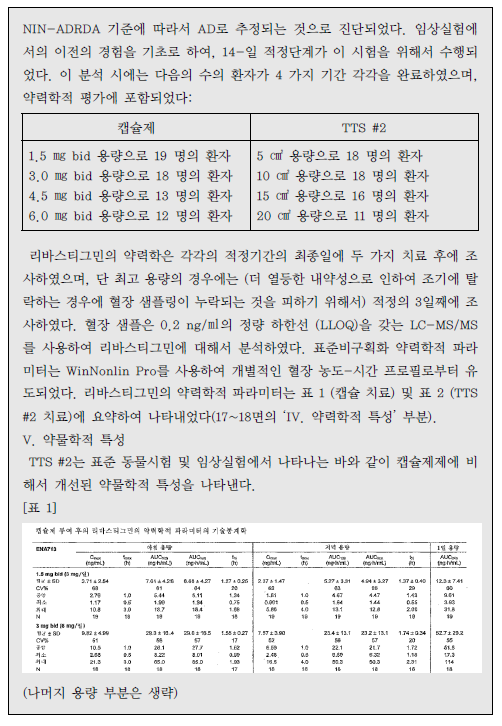
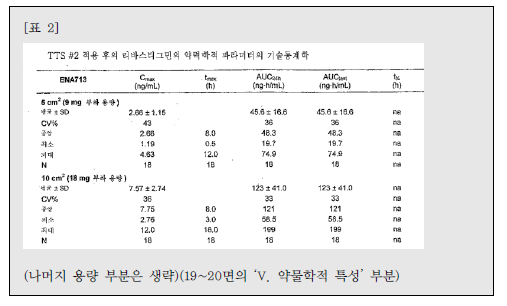
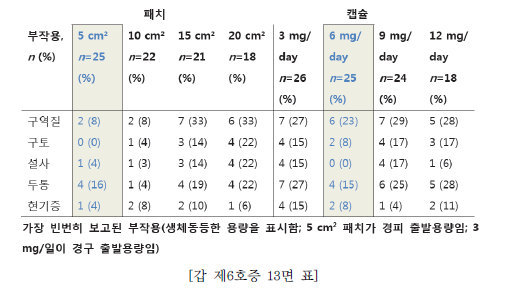
| 이사건 특허발명의 진보성이 부정되는지 여부 | 3. 이 사건 제1항 발명의 진보성 유무 가. 구성요소 2의 용법·용량의 기술적 의미 1) 특허청구범위 기재 내용 이 사건 제1항 발명은 용법‧용량과 관련하여 “1일 3mg 초과의 용량으로 리바스티그민을 제공하며 45.6±16.6 ng·h/mL의 AUC24h를 제공하는 …(중략)…출발용량으로 사용하기 위한 경피용 치료학적 시스템(TTS)“이라고 기재하고 있다. 위 특허청구범위의 기재에 의하면, ‘1일 3mg 초과의 용량으로 45.6±16.6ng·h/mL의 AUC24h를 제공’하는 것을 ‘리바스티그민 TTS의 출발용량’으로 하고있음을 알 수 있는데, 이러한 기재만으로는 ‘1일 3mg 초과의 용량으로45.6±16.6 ng·h/mL의 AUC24h를 제공’의 의미가 무엇인지 명확히 파악하기 어려우므로, 이하에서는 발명의 상세한 설명 등을 참작하여 그 기술적 의미를 살펴보기로 한다. 2) 1일 3mg 초과의 용량 이 사건 제1항 발명에는 ‘1일 3mg 초과의 용량’이 TTS의 부하용량15)을 의미하는지 아니면 방출용량16)을 의미하는 것인지 명시되어 있지 않다. 그런데,TTS의 경우에는 피부에 부착한 후 일정 시간이 경과한 뒤 떼어내게 되므로TTS에 함유된 약물 중 피부에 부착되어 있던 시간 동안 방출된 양만이 환자에게 전달되고 나머지는 패치와 함께 버려지게 되는 것인 점, 이 사건 제1항 발명의 특허청구범위에 1일 3mg 초과 용량의 활성성분의 흡수 정도를 나타내는45.6±16.6 ng·h/mL의 AUC24h값이 기재되어 있는 점 등을 고려하면, ‘1일 3mg초과의 용량’은 TTS의 부하용량이 아니라 방출용량으로 이해된다.그렇다면 ‘1일 3mg 초과의 용량’은 ‘1일 3mg 초과의 방출용량’이라고 할 것이다(이 점에 대하여는 당사자 사이에 다툼이 없다).17) 3) 45.6±16.6 ng·h/mL의 AUC24h를 제공 가) 이 사건 출원발명의 명세서에는 ‘45.6±16.6 ng·h/mL의 AUC24h’와 관련하여, [표 2]에 리바스티그민 9mg 부하용량을 가지는 5㎠의 TTS#2가‘45.6±16.6 ng·h/mL의 AUC24h’를 제공하는 것으로 기재되어 있으므로,‘45.6±16.6 ng·h/mL의 AUC24h’ 값은 크기가 5㎠이고 리바스티그민 9mg을 부하용량으로 함유하는 TTS#2를 24시간 동안 피부에 부착시켰을 때 얻어지는AUC 값이라는 것을 알 수 있다. 그러나 이 사건 출원발명의 명세서에는 위TTS#2의 패취로부터 피부에 제공되는 리바스티그민의 방출용량이 얼마인지를알 수 있는 기재나 암시가 전혀 나타나 있지 않다. 다만, 이 사건 출원발명 명세서의 [표 1]에는 리바스티그민 경구 투여의 경우 1일 3mg 투여시 ‘12.3±7.41ng·h/mL의 AUC24h’, 1일 6mg 투여시 ‘52.7±29.2 ng·h/mL의 AUC24h’인 것으로 기재되어 있으므로, 결국 이 사건 제1항 발명의 ‘45.6±16.6 ng·h/mL의AUC24h’ 값은 경구 투여시 출발용량인 ‘3mg/일’보다는 높고 그 다음 적정 용량인 ‘6mg/일’보다는 낮은 리바스티그민 용량에 해당하는 AUC 값임을 알 수 있을 뿐이다. 나) 이에 대하여 원고들은, 이 사건 제1항 발명의 '1일 3mg 초과의 용량으로리바스티그민을 제공하며 45.6±16.6 ng·h/mL의 AUC24h를 제공‘하는 것은 방출용량으로 4.6mg/일에 해당한다고 주장한다.살피건대, 갑 제6, 7, 8호증의 각 기재에 의하면, 시판되고 있는 엑셀론® 패취는 단위 면적이 5㎠이고, 주성분인 리바스티그민 함량(부하용량)이 9mg이며,방출용량이 4.6 mg/24h인 사실은 인정된다. 그런데, 위 인정사실 및 갑 제1호증의 기재에 변론 전체의 취지를 종합하여 알 수 있는 다음과 같은 사정들, 즉 ① 갑 제6, 7, 8호증에는 엑셀론® 패취의 AUC24h가 이 사건 출원발명의 TTS#2패취의 ‘45.6±16.6 ng·h/mL의 AUC24h‘와 동일하다고 볼 만한 기재나 암시가전혀 나타나 있지 않은 점, ② 이 사건 출원발명의 명세서 [표 1, 2]에 의하면그 측정되는 AUC24h값은 아래 표에서 보는 바와 같이 상당히 넓은 범위의 편차를 보이고 있고, 심지어 더 높은 용량을 투여하였음에도 측정되는 AUC24h값은오히려 더 낮게 나오는 경우도 있는 점, ③ 측정되는 AUC24h값은 동일한 용량을투여하더라도 개인 간의 측정되는 수치의 차이가 상당히 크고, 분석 방법에 따른 차이도 크기 때문에 통상의 기술자가 위와 같이 측정된 AUC24h값으로부터투여된 패취의 방출용량을 예측하는 것은 사실상 불가능한 것으로 보이는 점 등에 비추어 보면, 리바스티그민의 경피 투여에서 ‘45.6±16.6 ng·h/mL의AUC24h’를 제공하는 용량이 방출용량으로는 ‘4.6mg/일’에 해당한다는 원고들의위 주장은 받아들일 수 없다. 다) 그렇다면, 이 사건 제1항 발명의 ‘45.6±16.6 ng·h/mL의 AUC24h’ 값은크기가 5㎠이고 리바스티그민 9mg을 부하용량으로 함유하는 TTS#2를 24시간동안 피부에 부착시켜 측정한 AUC 값을 단순히 기재한 것으로서, 이는 경구 투여의 출발용량인 3mg/일 투여 용량보다는 높고 6mg/일 투여 용량보다는 낮은리바스티그민 용량에 해당하는 AUC 값이라는 정도의 기술적 의미만 있을 뿐,리바스티그민 TTS의 출발용량을 이와 같이 한정하는 기술적 의미가 있다고 보기는 어렵다. 4) 검토 결과 이상과 같은 제반 사정을 종합하여 보면, 리바스티그민 TTS의 출발용량으로‘1일 3mg초과의 용량으로 45.6±16.6 ng·h/mL의 AUC24h를 제공’하는 것은, 리바스티그민의TTS의 출발용량으로 1일 3mg 초과의 방출용량을 투여하여 경구투여시 출발용량인 3mg/일 투여 용량보다는 높고 용량 적정에서 다음 단계의용량인 경구 6mg/일 투여 용량보다는 낮은 리바스티그민 용량에 해당하는45.6±16.6 ng·h/mL의 AUC24h값을 갖는다는 점에 그 기술적 의미가 있다고 할것이다. 나. 선행발명과의 대비 1) 구성요소별 대응관계 2) 공통점 및 차이점 가) 구성요소 1 이 사건 제1항 발명의 구성요소 1은 ‘a) 배면층 b) 리바스티그민 및 하나이상의 c) 접착층을 포함하고, 중합체를 포함하는 저장층‘으로, 리바스티그민을활성성분으로 포함하는 패치 구성에 관한 것인데, 선행발명에는 ’배킹층, 화합물 A(리바스티그민에 해당) 및 접착층‘을 포함하는 경피용 장치가 나타나 있으므로, 이 사건 제1항 출원발명의 구성요소 1은 선행발명의 대응 구성과 실질적으로 동일하다(구성요소 1에 대하여는 당사자 사이에 다툼이 없다). 나) 구성요소 2 이 사건 제1항 발명의 구성요소 2는 ‘1일 3mg 초과의 용량으로 리바스티그민을 제공하며 45.6 ±16.6 ng·h/mL의 AUC24h를 제공하는 치매 또는 알츠하이머병의 예방, 치료, 또는 진행의 지연을 위한 출발용량으로 사용하기 위한 경피용 치료학적 시스템(TTS)’인데, 선행발명에도 리바스티그민이 알츠하이머병의 치료에 유용하고 경피용 장치로 제공할 수 있다는 점이 나타나 있으므로, 양발명은 알츠하이머병의 치료에 사용하기 위한 경피용 치료학적 시스템(경피용장치)라는 점에서 동일하다.다만, 앞서 본 바와 같이 이 사건 제1항 발명은 리바스티그민 TTS의 방출용량으로 1일 3mg 초과의 용량을 투여하여 경구 투여시 출발용량인 3mg/일 투여용량보다는 높고 다음 용량 적정단계 용량인 경구 6mg/일 투여 용량보다는 낮은 리바스티그민 용량에 해당하는 45.6±16.6 ng·h/mL의 AUC24h값을 갖는 것인데, 선행발명에는 리바스티그민 TTS의 위와 같은 출발용량에 대한 명시적인기재가 없다는 점에서 차이가 있다. 3) 차이점에 대한 검토 가) 1일 3mg 초과의 방출용량 (1) 선행발명의 기재 내용 선행발명의 명세서(갑 제5호증)에 기재된 다음과 같은 내용에 의하면, 리바스티그민은 경구 투여시 출발용량은 3mg/일, 투여가능 최고 용량은 12mg/일이고, 경피 투여시 12mg이 흡수되는 투여량에서도 잘 견디며, 특히 24mg/일(경구 투여가능 최고 용량의 두 배에 해당)이 흡수되는 경우 경구 투여에 비해경피 투여의 경우에 그 부작용이 더 적다는 것을 알 수 있다. (2) 이 사건 출원발명의 우선일 당시의 기술상식 (가) 을 제2, 3, 4호증에 기재된 다음과 같은 내용에 비추어 보면, 이 사건출원발명의 우선일 당시 리바스티그민은 경구 투여시 용량 증가에 따른 위장관부작용이 나타나므로, 약효를 나타내는 용량에 비하여 낮은 용량을 출발용량으로 하여 최대 내성용량까지 용량 적정18) 단계를 거쳐야 하는 것으로 잘 알려져있었음을 알 수 있다. (나) 갑 제9호증, 을 제7, 9호증에 기재된 다음과 같은 내용에 비추어 보면,이 사건 출원발명의 우선일 당시 리바스티그민의 경구 투여시 용량 증가에 따른위장관 부작용은 최고 혈중농도(Cmax)20)와 관련이 있다는 점, 그리고 경피 투여제형인 패취제는 약물방출이 서서히 진행되는 방출조절제형으로 경구 투여 제형에비하여 Cmax가 낮다는 점이 통상의 기술자에게 잘 알려져 있었음을 알 수 있다. (3) 검토 결과 (가) 앞서 본 이 사건 출원발명의 우선일 당시의 기술상식과 선행발명으로부터 알 수 있는 다음과 같은 사정들, 즉 ① 리바스티그민의 경구 투여시 용량증가에 따른 위장관 부작용이 나타나게 되므로 용량 적정을 위해 1일 3mg을 그출발용량으로 설계하였던 것이고, 따라서 통상의 기술자로서는 위 부작용을 줄일 수 있다면 리바스티그민의 약효를 증대시키기 위하여 보다 높은 용량을 투여할 것임은 자명해 보이는 점, ② 리바스티그민의 부작용은 Cmax와 관련이 있는것으로 알려져 있었고, 경피 투여의 경우 경구 투여보다 Cmax가 낮으므로 경구투여에 비하여 부작용이 적게 나타난다는 것을 용이하게 인식할 수 있었던 점,③ 더욱이 선행발명으로부터 리바스티그민의 경피 투여시 12mg이 흡수되는 투여량에서도 잘 견디고, 24mg/일(경구 투여가능 최고 용량의 두 배에 해당)이흡수되는 경우 경구 투여에 비해 경피 투여시에 그 부작용이 더 적다는 것을 명확하게 인식할 수 있었던 점 등에 비추어 보면, 통상의 기술자는 리바스티그민TTS의 출발용량을 리바스티그민 경구 출발용량인 1일 3mg 보다 더 높게 설정하여 ‘1일 3mg 초과의 방출용량’을 적용하는 것을 어렵지 않게 도출할 수 있다고 봄이 상당하고, 이에 어긋나는 갑 제14, 24호증의 각 기재는 쉽사리 믿기 어렵다. (나) 이에 대하여 원고들은, 이 사건 출원발명의 우선일 당시 리바스티그민의 위장관 부작용이 Cmax보다 AUC에 더 관련 있다는 것이 당업계의 인식이었고, 이러한 당업계의 인식은 Srameck 논문[‘잠재적 알츠하이머 질환 환자에서SDZ ENZ 713의 안정성/내성 시험’ 보고서(1996.), 갑 제6호증의 첨부물 9]에기재된 바와 같이 리바스티그민 경구 1일 2회 투여와 1일 3회 투여한 실험결과에서 양자 사이에 부작용 정도에 차이가 없는 것으로 나타나는 등 리바스티그민의 경우 Cmax와 부작용 발생 사이에 직접 비례 관계가 성립하지 않는다는 점이이에 의해 뒷받침되므로, 리바스티그민 TTS가 경구 제형에 비하여 부작용이 더낮을 것이라고 기대할 수는 없었다고 주장한다. 살피건대, 위 인정사실 및 갑 제6호증, 을 제5호증의 1의 각 기재에 변론 전체의 취지를 종합하여 알 수 있는 다음과 같은 사정들에 비추어 보면, 리바스티그민의 부작용은 Cmax와 밀접한 관련이 있을 뿐 아니라 경피 투여가 경구 투여에 비해 부작용이 더 낮을 것으로 예측된다고 할 것이므로, 이와 다른 전제에 선 원고들의 위 주장은 받아들이기 어렵다. ① 일반적으로 AUC가 증가하면 Cmax 또한 어느 정도 상승하게 되고, 이로인해 부작용이 증가하게 될 가능성도 높아지게 되므로 이런 관점에서 AUC가부작용과 전혀 무관하다고는 볼 수 없다. 그러나 선행발명에서는 리바스티그민24mg이 24시간 내에 흡수되는 경우에 경구 투여보다 경피 투여가 부작용이 더적게 나타났는바, 경피 투여의 경우 ‘초회 통과 효과’를 회피할 수 있기 때문에그 AUC는 동일 용량의 경구 투여보다 높게 나타나게 될 것임이 분명하고, 한편리바스티그민의 경구 투여시 반감기가 1 내지 1.5시간으로 짧아 약물의 소실속도가 매우 빠르기 때문에 AUC가 낮게 나타나지만, 경피 투여시에는 약물이 서서히 흡수되어 일정기간 지속되게 됨에 따라 경구 투여에 비해 AUC가 높게 나타날 것으로 예측되므로, 이로부터 리바스티그민은 동일 용량의 경구 투여보다경피 투여에서 AUC가 상당히 높게 나타날 것이 명확히 예측된다고 할 것이다.그런데 선행발명에서는 경피 투여의 경우 부작용이 오히려 더 적게 나타났으므로, 이로부터 리바스티그민의 부작용이 AUC가 아닌 Cmax와 직접적인 관계가 있음을 용이하게 인식할 수 있다고 할 것이다. ② Srameck 논문에 의하면 리바스티그민을 1일 2회, 1일 3회 경구 투여한경우의 부작용 발생 빈도에 차이가 없다고 기재되어 있기는 하다. 그러나 해당실험에서는 리바스티그민을 1일 2mg에서부터 최종 12mg까지의 용량을 총 9주동안 투여하고 위 전체 기간 동안에 발생한 부작용을 그 결과로 기재하고 있는데, 약물의 지속적인 반복투여로 인해 약물의 최대 혈중농도가 상승하게 된다는점을 감안하면, 지속적인 리바스티그민의 경구 투여에 의해 1일 2회 투여나 1일3회 투여 모두 독성을 나타내는 농도를 초과한 Cmax에 도달한 상태가 됨으로써위와 같이 유사한 부작용 발생 빈도가 나타났을 가능성을 배제하기 어렵다.(다) 또한 원고들은, 이 사건 출원발명의 우선일 당시 약물의 경피 제형은‘초회 통과 효과’를 회피할 수 있기 때문에 그 출발용량은 경구 출발용량보다 낮게 설정하는 것이 일반적이었고(대표적인 사례로는 클로니딘, 에스트라디올 및옥시부티닌의 약물이 있다), 특히 리바스티그민의 경우는 경구 투여시 현저히큰 ‘초회 통과 효과’와 ‘비선형 약동학적 특성’을 나타낸다고 알려져 있었으므로, TTS 출발용량을 높게 설정하면 부작용의 가능성이 높게 되고, 따라서 통상의 기술자는 경구 출발용량인 1일 3mg보다 훨씬 낮은 용량이 필요하다고 생각하였을 것이라고 주장한다. 살피건대, 갑 제9, 15 내지 21호증, 을 제6호증의 각 기재에 의하면, ⅰ) 경피투여의 경우 경구 투여에 따른 초회 통과 효과를 회피할 수 있으므로 더 많은약물이 혈중으로 공급되고(을 제6호증의 519면), 클로니딘, 에스트라디올, 옥시부티닌의 경우 경피 투여 용량이 경구 투여 용량보다 낮게 나타나며(갑 제15 내지 21호증), 리바스티그민의 경우 경구 투여시 약 35%의 생체이용율이 나타나므로 초회 통과 효과가 크다는 사실(갑 제9호증의 634면), ⅱ) 리바스티그민은용량 제한적 배설로 인해 비선형 약동학적 특성을 나타내게 되므로, Cmax와AUC는 경구 투여 및 정맥 투여 모두에서 용량 증가에 비례하는 것보다 더 크게증가하는 사실(갑 제9호증의 634면, 갑 제21호증의 226면)이 각 인정된다.그런데, 앞서 인정한 사실관계에 변론 전체의 취지를 종합하여 알 수 있는 다음과 같은 사정들, 즉 ① 경피 제형의 용량이 경구 제형의 용량에 비하여 낮게설정되는 것이 모든 약물에 동일하게 적용된다고 할 수 없고, 경구 제형으로 개발된 약물을 경피 제형으로 변경하고자 할 때 그 용량은 해당 약물의 약리학적및 약물동력학적 성질을 고려하여 설계하여야 하는 점, ② 이 사건 출원발명의우선일 당시 리바스티그민의 약리학적 및 약물동력학적 성질이 이미 공지되어있었으므로, 통상의 기술자라면 위와 같은 리바스티그민의 성질을 고려하여TTS의 출발용량을 설계할 것이라고 봄이 합리적이고, 이와 달리 리바스티그민이 아닌 다른 약물들의 사정을 우선적으로 고려할 것이라고 보기는 어려운 점,③ 리바스티그민의 경구 투여시 용량 증가에 따른 위장관 부작용이 나타나게 됨에 따라 용량 적정을 위해 1일 3mg을 그 출발용량으로 설계하였던 점에 비추어, 통상의 기술자로서는 위 부작용을 줄일 수 있다면 리바스티그민의 약효를증대시키기 위하여 보다 높은 용량을 투여할 것임이 자명한 점, ④ 리바스티그민의 부작용은 Cmax와 관련이 있다고 알려져 있었고, 경피 투여의 경우 경구 투여에 비해 Cmax가 낮으므로 리바스티그민의 경구 투여에 비하여 부작용이 적게나타난다는 것을 용이하게 인식할 수 있을 뿐만 아니라, 이러한 사실은 선행발명에 나타난 ‘리바스티그민의 경피 투여시 12mg이 흡수되는 투여량에서도 잘견디며, 24mg/일(경구 투여 가능 최고 용량의 두 배에 해당)이 흡수되는 경우경구 투여보다 경피 투여가 부작용이 더 적다’는 사실로부터도 충분히 예측할수 있으므로, 리바스티그민의 TTS의 출발용량을 경구 투여의 출발용량보다 높게 설정하는 데 어떠한 어려움이 있었다고 보이지 않는 점 등에 비추어 보면,위 인정사실만으로 통상의 기술자가 리바스티그민 TTS의 출발용량을 경구 투여시의 출발용량보다 낮은 용량으로 설정하였을 것이라고 보기 어렵다. 따라서 원고들의 위 주장 역시 이유 없다. 나) 45.6±16.6 ng·h/mL의 AUC24h 값 위 인정사실 및 을 제5호증의 1의 기재에 변론 전체의 취지를 종합하여 인정되는 다음과 같은 사정들에 비추어 보면, 통상의 기술자는 이 사건 기술분야의 기술상식을 참작하여 선행발명으로부터 리바스티그민 TTS의 ‘45.6±16.6ng·h/mL의 AUC24h’ 값을 그리 어렵지 않게 도출할 수 있다고 할 것이다. ① 통상의 기술자는 선행발명으로부터 ‘리바스티그민의 경피 투여시 12mg이 흡수되는 투여량에서도 잘 견디며, 24mg/일(경구 투여가능 최고 용량의 두배에 해당)이 흡수되는 경우 경구 투여보다 경피 투여가 부작용이 더 적다’는 것을 쉽게 인식할 수 있으므로, 리바스티그민 TTS의 출발용량을 경구 출발용량인1일 3mg 보다 더 높게 설정하여 ‘1일 3mg 초과의 방출용량’을 적용하는 방법을어렵지 않게 도출할 수 있다. ② 리바스티그민 TTS의 경우 ‘초회 통과 효과’를 회피하게 되어 경구 투여에 비하여 더 많은 약물이 혈중으로 공급되게 되므로, 위와 같이 1일 3mg을 초과하는 방출용량으로 리바스티그민을 제공하는 패취제를 투여할 경우, 경구 투여시의 출발용량 3mg의 AUC24h 값에 비하여 더 높은 AUC24h 값을 나타내리라는 것은 통상의 기술자가 충분히 인식할 수 있다. ③ 리바스티그민의 혈중 반감기는 1 내지 1.5시간으로 매우 짧기 때문에 약물이 한꺼번에 흡수되는 경구 투여의 경우 AUC 값은 더욱 줄어들 것으로 예측되고, 따라서 통상의 기술자는 경피 투여의 AUC 값이 경구 투여에 비해 상당히높을 것이라는 점을 용이하게 인식할 수 있다. 4) 기타 원고들의 주장에 대한 판단 가) 원고들은 먼저, 이 사건 제1항 발명은 리바스티그민 TTS의 출발용량에 관한 것으로서, TTS에 함유된 리바스티그민의 분해를 감소시키는 선행발명과는전혀 별개의 것이므로, 선행발명에 비하여 목적의 특이성이 있다고 주장한다.살피건대, 선행발명에는 리바스티그민 TTS의 출발용량에 대하여 명시적으로기재하고 있지는 않지만, 의약발명 분야에서 공지된 물질의 약리효과는 유지하면서 독성이나 부작용이 나타나지 않는 범위 내에서 적정한 투여 용량을 설계하는 것은 일반적으로 추구하는 기술적 과제이고, 앞서 본 바와 같이 통상의 기술자는 이 사건 출원발명의 우선일 당시의 기술상식을 참작하여 선행발명으로부터 ‘리바스티그민 TTS의 출발용량을 경구 투여의 출발용량보다 높은 1일 3mg초과의 방출용량으로 하고 45.6±16.6 ng·h/mL의 AUC24h 값을 갖는 구성’을 용이하게 도출할 수 있으므로, 이 사건 제1항 발명은 선행발명에 비하여 목적의특이성이 있다고 볼 수 없다. 따라서 원고들의 위 주장은 이유 없다. 나) 원고들은 다음으로, 다른 알츠하이머병 치료제인 도네피질(donepezil)과메만틴(memantime)의 사례에 의하면 약물의 최대용량과 출발용량 사이에는 상관관계가 없으므로 선행발명에 리바스티그민 TTS 제형이 최대용량이 높다고 기재되어 있다는 이유만으로 출발용량도 더 높을 것으로 추론할 수 없으므로, 통상의 기술자가 경구 투여의 출발용량에 비해 높은 경피 투여의 출발용량을 선택하는 것은 용이하지 않다고 주장한다. 살피건대, 갑 제12, 13호증의 각 기재에 의하면, 알츠하이머 치료제인 ‘도네피질(donepezil)’과 ‘메만틴(memantime)’ 경구 제형을 비교해 보면, 최대 허가 용량은 메만틴(memantime)이 더 높으나, 출발용량은 두 약물이 동일한 사실이인정된다.그런데, 위 인정사실에 변론 전체의 취지를 종합하여 인정되는 다음과 같은사정들, 즉 ① 갑 제12, 13호증은 서로 다른 활성물질을 갖는 약물에서 출발용량이 각각 동일하더라도 최대 허가 용량이 다를 수 있음을 보여주는 자료에 불과할 뿐이고, 통상의 기술자라면 공지된 리바스티그민의 성질을 고려하여 TTS의 출발용량을 설계한다고 보는 것이 합리적이므로, 이를 도외시하고 오히려 다른 약물의 사례를 참작하여 리바스티그민 TTS의 출발용량에 고려할 것이라고보기는 어려운 점, ② 선행발명에는 리바스티그민 경구 최대 투여량인 12mg의두 배의 용량에 해당하는 24mg/일을 흡수시키는 경우에 경피용 장치에서 부작용 발생이 더 낮다는 사실이 기재되어 있으므로, 위 내용을 접한 통상의 기술자라면 동일한 용량이 흡수되는 경우에 경구 투여보다 경피 투여가 부작용 발생비율이 낮다는 것을 용이하게 인식할 수 있는 점 등에 비추어 보면, 통상의 기술자는 리바스티그민 경구 투여의 출발용량에 비해 더 높은 경피 투여의 출발용량을 선택하는 것을 용이하게 도출할 수 있다고 봄이 타당하다. 따라서 원고들의 위 주장은 이유 없다. 다) 또한 원고들은, 선행발명과 공지 기술들을 고려하더라도 이 사건 제1항발명이 공지된 리바스티그민 경구 제제보다 부작용이 현저히 더 낮을 것에 대한“성공에 대한 합리적 기대 하에” 이 사건 제1항 발명의 리바스티그민 경피 제제의 출발용량을 선택할 수 없었을 것이므로, 이 사건 제1항 발명은 선행발명에의해서 진보성이 부정될 수 없다고 주장한다. 살피건대, 앞서 본 바와 같이 이 사건의 경우 선행발명에 리바스티그민 경구최대 투여량인 12mg의 두 배의 용량에 해당하는 24mg/일을 흡수시키는 경우에경피용 장치에서 부작용 발생이 더 낮다는 사실이 나타나 있으므로 경피 투여시출발용량 증가에 대한 암시와 동기가 선행발명에 이미 제시되어 있다고 할 것이다. 또한 이 사건 제1항 발명의 진보성 유무에 관한 앞서의 판단은 그 우선일 당시의 기술수준, 기술상식, 해당 기술분야의 기본적 과제, 발전경향, 해당 업계의요구 등(대법원 2007. 9. 6. 선고 2005후3284 판결 등 참조)의 제반 사정들을고려하여 통상의 기술자가 이 사건 제1항 발명의 효과를 합리적·논리적으로 예측하여 이 사건 제1항 발명에 이를 수 있다고 판단한 것이지, 단순히 발명을 실시해 볼 가능성 내지 성공에 대한 단순한 희망 등의 이유만으로 그 진보성 유무를판단한 것이 아니므로, 이와 다른 전제에 선 원고들의 위 주장은 이유 없다 라) 마지막으로 원고들은, 이 사건 제1항 발명의 특징은 ‘1일 3mg 초과의 용량으로 리바스티그민을 제공’하며 ‘45.6±16.6 ng·h/mL의 AUC24h’ 값을 제공하는 용량을 리바스티그민 경피제제의 “출발용량”으로 사용하는 데 있으므로, 가사 선행발명에 이 사건 출원발명의 경피 제제와 조성이 유사한 경피 제제가 개시되어 있다고 하더라도 출발용량에 대한 개시가 없는 한 이를 이 사건 제1항발명의 진보성 부정 근거로 삼을 수 없다고 주장한다. 살피건대, 앞서 본 바와 같이 선행발명에는 리바스티그민의 경피 제형의 구성과 알츠하이머 질환의 치료 용도가 명시되어 있고, 리바스티그민 경구 최대 투여량인 12mg의 두 배의 용량에 해당하는 24mg/일을 흡수시키는 경우에 경피용장치에서 부작용 발생이 더 낮다는 기재 사실로부터 경피 투여시 출발용량이 경구 투여시 출발용량에 비해 증가시킬 수 있다는 점에 대한 암시나 동기가 제시되어 있다고 할 것이므로, 이와 달리 선행발명이 이 사건 제1항 발명의 진보성부정의 근거가 될 수 없다는 원고들의 위 주장은 받아들일 수 없다. 다. 효과의 현저성 1) 명세서 기재 내용 이 사건 출원발명의 명세서(갑 제1호증)에는 이 사건 제1항 발명의 ‘개선된내약성’ 및 ‘용량 적정단계의 감소’ 효과와 관련하여 다음과 같은 내용이 기재되어 있다. 2) 개선된 내약성 가) 위 명세서 기재 내용에 의하면, 리바스티그민 TTS는 리바스티그민 캡슐제의 노출과 동등한 수준(AUC24h)에 비해서 오심 및 구토와 같은 위장관 부작용에 있어 개선된 내약성을 나타낸다고 기재되어 있기는 하나, 이에 관한 임상실험 결과로 제시된 ‘IV. 약력학적 특성’에 관한 [표](갑 제1호증의 18면)에는 각단계에서 탈락된 환자가 위장관 부작용에 의하여 탈락된 것인지를 구체적으로확인할 만한 기재가 없다. 설령, 탈락된 환자가 위장관 부작용 발생에 기인한것이라고 하더라도, 위 명세서 기재로부터 알 수 있는 다음과 같은 사정들, 즉① 캡슐제는 출발용량인 1.5mg BID(3mg/일)에서 다음 용량인 3mg BID(6mg/일)으로 상승되는 과정에서 19명의 환자 중 한 명이 탈락하였고, TTS #2는 출발용량인 5㎠(9mg 부하용량)에서 다음 용량인 10㎠(18mg 부하용량)로 상승될때 18명의 환자 중 탈락자가 없었는데, 탈락자 한 명의 유무만으로 이 사건 제1항 발명이 리바스티그민의 경구 투여 보다 개선된 내약성을 갖는다고 단정하기어려운 점, ② 출발용량부터 최대 용량 투여시에 탈락하지 않고 남아있는 환자의 수를 비교하여 보면, 리바스티그민 캡슐제의 경우 19명에서 12명, 리바스티그민 TTS의 경우 18명에서 11명으로 전체 탈락 환자의 수는 7명으로 동일하게 나타나는 점 등에 비추어 보면, 위와 같은 명세서 기재 내용만으로 이 사건 제1 항 발명이 리바스티그민 캡슐제에 비하여 어느 정도의 개선된 내약성을 갖는지를 확인하기는 어렵다고 할 것이다. 나) 이에 대하여 원고들은, 이 사건 제1항 발명이 리바스티그민 캡슐제에 비하여 개선된 내약성이 있다는 점을 증명하기 위하여 이 사건 출원발명의 우선일이후에 엑셀론® 패치의 허가 과정 및 허가 후의 임상 연구에서 조사된 비교실험자료(갑 제6호증의 13면 아래 [표] 참조)를 증거로 제시하고 있으므로, 이에관하여 본다.위 표에 의하면, 리바스티그민 TTS 출발용량 투여시의 구역질 및 구토 등의부작용 발생비율이 경구 투여의 출발용량(3mg/일)뿐만 아니라 위 출발용량에적응된 후에 투여된 경구 투여 제1유지 용량(6mg/일)의 발생비율보다 더 낮게나타나 있는 사실은 인정된다. 그런데, 앞서 본 바와 같이 ① 이 사건 출원발명의 우선일 당시에 리바스티그민의 부작용은 Cmax와 관련이 있는 것으로 알려져있었고, 경피 투여의 경우 약물 방출이 서서히 진행되게 되어 경구 투여의 경우보다 Cmax가 낮게 나타나는 것은 기술상식이므로, 리바스티그민의 TTS는 경구투여에 비하여 부작용이 적게 나타난다는 것을 용이하게 인식할 수 있는 점, ②더욱이 선행발명에는 리바스티그민의 경피 투여시 12mg이 흡수되는 투여량에 서도 잘 견디고, 24mg/일(경구 투여 가능 최고 용량의 두 배에 해당)이 흡수되는 경우 경구 투여에 비해 경피 투여시 그 부작용이 더 적다는 것이 나타나 있는 점 등에 비추어 보면, 이 사건 제1항 발명의 경피 투여 출발용량의 부작용발생 비율이 리바스티그민 캡슐제와 같은 경구 투여 제1유지용량(6mg/일)에 비하여 더 적을 것이라는 점은 통상의 기술자가 충분히 예측할 수 있다고 할 것이다. 따라서 이를 현저한 효과라고 보기는 어려우므로, 원고들의 위 주장은 받아들일 수 없다. 3) 용량 적정단계의 감소 위 명세서 기재 내용에 의하면, 이 사건 제1항 발명의 리바스티그민 TTS는내약성이 개선되어 더 많은 출발용량을 제공할 수 있으므로 감소된 수의 용량적정단계를 이용할 수 있는 효과가 있음을 알 수 있다. 그리고 갑 제5, 8호증의각 기재에 의하면, 리바스티그민의 경구 투여시 3mg/일, 6mg/일, 9mg/일 및12mg/일의 4단계 용량 적정단계가 적용되고, 시판되고 있는 엑셀론 패취의 경우 방출용량을 기준으로 4.6mg(크기: 5㎠, 부하용량: 9mg), 9.5mg(크기: 10㎠, 부하용량: 18mg) 및 13.3mg(크기: 15㎠, 부하용량: 27mg)의 3단계 용량적정단계가 적용되는 사실은 인정된다.그런데 앞서 본 바와 같이 통상의 기술자는 이 사건 출원발명의 우선일 당시의 기술상식 및 선행발명으로부터 리바스티그민의 TTS의 출발용량을 경구 투여의 출발용량보다 높게 설정하는 데 어떠한 어려움이 있다고 볼 수 없고, 용량적정 단계의 감소 효과는 출발용량을 높임으로 인하여 얻어지는 당연한 효과인점을 고려하면, 이 사건 제1항 출원발명의 용량 적정단계가 적어지는 효과는 통상의 기술자가 예측할 수 없는 현저한 효과에 해당한다고 볼 수 없다. 다. 검토 결과 이상과 같은 제반 사정을 종합하면, 이 사건 제1항 발명은 통상의 기술자가선행발명으로부터 용이하게 도출할 수 있으므로, 결국 그 진보성이 부정된다.그리고 특허청구범위가 여러 개의 청구항으로 되어 있는 경우, 그 하나의 항이라도 거절이유가 있는 때에는 그 출원이 전부 거절되어야 할 것인데, 위에서살펴본 바와 같이 이 사건 제1항 발명은 그 진보성이 부정되어 특허받을 수 없으므로, 나머지 청구항에 관하여 더 나아가 살펴볼 필요 없이 이 사건 출원발명은 특허를 받을 수 없다고 할 것이다. 따라서 이와 결론을 같이 한 이 사건 심결은 적법하다. |
| 결론 | 4. 결 론 그렇다면 이 사건 심결의 취소를 구하는 원고들의 청구는 이유 없으므로 이를 모두 기각하기로 하여 주문과 같이 판결한다. |
















| 번호 | 사건번호 | 제목 | 분야 | 출원번호 | 법원명 | 날짜 | 조회 수 |
|---|---|---|---|---|---|---|---|
| » | 2016허4368 거절결정(특) |
2016허4368 거절결정(특)
|
특허/실용신안 | 2008-7013112 | 특허법원 | 2020.06.26 | 50 |
| 213 | 2016허3808 거절결정(특) |
2016허3808 거절결정(특)
|
특허/실용신안 | 제10-2014-7000557호 | 특허법원 | 2020.06.26 | 74 |
| 212 | 2016허830 등록정정(특) |
2016허830 등록정정(특)
|
특허/실용신안 | 제10-577057호 | 특허법원 | 2020.06.25 | 38 |
| 211 | 2015허5883 권리범위확인(특) |
2015허5883 권리범위확인(특)
|
특허/실용신안 | 제954978호 | 특허법원 | 2020.06.25 | 296 |
| 210 | 2016허4405 등록무효(특) | 2016허4405 등록무효(특) | 특허/실용신안 | 제0491282호 | 특허법원 | 2020.06.25 | 116 |
| 209 | 2015허7346 등록무효(특) |
2015허7346 등록무효(특)
|
특허/실용신안 | 제10-1431070호 | 특허법원 | 2020.06.25 | 67 |
| 208 | 2015허6732 등록무효(특) |
2015허6732 등록무효(특)
|
특허/실용신안 | 제1433188호 | 특허법원 | 2020.06.25 | 75 |
| 207 | 2015허5227 등록무효(특) |
2015허5227 등록무효(특)
|
특허/실용신안 | 제10-0406684호 | 특허법원 | 2020.06.25 | 58 |
| 206 | 2016허229 거절결정(특) |
2016허229 거절결정(특)
|
특허/실용신안 | 제10-2013-78658호 | 특허법원 | 2020.06.25 | 26636 |
| 205 | 2015허6169 거절결정(특) |
2015허6169 거절결정(특)
|
특허/실용신안 | 제10-2010-7006808호 | 특허법원 | 2020.06.25 | 50 |
| 204 | 2015허5142 거절결정(특) |
2015허5142 거절결정(특)
|
특허/실용신안 | 제10-2014-7013141호 | 특허법원 | 2020.06.25 | 25 |
| 203 | 2015허4217 거절결정(특) |
2015허4217 거절결정(특)
|
특허/실용신안 | 제2008-7008462호 | 특허법원 | 2020.06.25 | 42 |
| 202 | 2015허5654 권리범위확인(특) |
2015허5654 권리범위확인(특)
|
특허/실용신안 | 제10-1998-13940호 | 특허법원 | 2020.06.24 | 54 |
| 201 | 2015허5593 권리범위확인(특) |
2015허5593 권리범위확인(특)
|
특허/실용신안 | 제10-1998-13940호 | 특허법원 | 2020.06.24 | 59 |
| 200 | 2015허4804 권리범위확인(특) |
2015허4804 권리범위확인(특)
|
특허/실용신안 | 제878255호 | 특허법원 | 2020.06.24 | 57 |
| 199 | 2015허4750 권리범위확인(특) |
2015허4750 권리범위확인(특)
|
특허/실용신안 | 제10-1375554호 | 특허법원 | 2020.06.24 | 31 |
| 198 | 2016허76 등록무효(특) | 2016허76 등록무효(특) | 특허/실용신안 | 제756225호 | 특허법원 | 2020.06.24 | 26 |
| 197 | 2015허7360 등록무효(특) |
2015허7360 등록무효(특)
|
특허/실용신안 | 제1060277호 | 특허법원 | 2020.06.24 | 51 |
| 196 | 2015허7087 등록무효(실) |
2015허7087 등록무효(실)
|
특허/실용신안 | 제460902호 | 특허법원 | 2020.06.24 | 64 |
| 195 | 2015허4279 등록무효(특) |
2015허4279 등록무효(특)
|
특허/실용신안 | 제10-1399523호 | 특허법원 | 2020.06.24 | 50 |